HIV-1 là một trong những virus gây ra các bệnh lý nghiêm trọng nhất trên thế giới và vẫn đang là một thách thức lớn trong việc điều trị và phòng ngừa. Trong nhiều năm qua, các nhà khoa học đã nỗ lực tích cực để tìm ra các phương pháp điều trị mới và hiệu quả hơn cho HIV-1. Mới đây, một loại thuốc mới được chấp thuận sử dụng trong điều trị HIV-1 đã thu hút sự chú ý của cộng đồng y tế. Đó là Lenacapavir – thuốc ức chế capsid đầu tiên trong điều trị HIV-1
1.Tổng quan về HIV/ AIDS
1.1 HIV là gì?
HIV (virus gây suy giảm miễn dịch ở người) là một loại virus tấn công hệ thống miễn dịch của cơ thể. Nếu HIV không được điều trị, nó có thể dẫn đến AIDS (hội chứng suy giảm miễn dịch mắc phải). Nhưng với sự chăm sóc y tế thích hợp, HIV có thể được kiểm soát. Những người nhiễm HIV được điều trị HIV hiệu quả có thể sống lâu, khỏe mạnh. Nhiễm HIV ở người đến từ một loại tinh tinh ở Trung Phi và các nghiên cứu cho thấy HIV có thể đã lây từ tinh tinh sang người từ cuối những năm 1800. Trong nhiều thập kỷ, HIV dần dần lan rộng khắp Châu Phi và sau đó lan sang các khu vực khác trên thế giới. Virus này đã tồn tại ở Hoa Kỳ ít nhất là từ giữa đến cuối những năm 1970
1.2 Các triệu chứng khi nhiễm HIV?
Đối với hầu hết mọi người, các triệu chứng giống như cúm trong vòng 2 đến 4 tuần sau khi nhiễm bệnh. Các triệu chứng có thể kéo dài trong vài ngày hoặc vài tuần. Một số người không có triệu chứng và cách duy nhất để biết chắc là làm các xét nghiệm
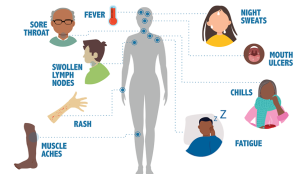
1.3 Các giai đoạn khi bắt đầu nhiễm HIV?
Khi những người nhiễm HIV không được điều trị, các bệnh nhân trải qua 3 giai đoạn. Nhưng điều trị HIV có thể làm chậm hoặc ngăn chặn sự tiến triển của bệnh. Với những tiến bộ trong điều trị HIV, sự tiến triển đến giai đoạn 3 (AIDS) ngày nay ít phổ biến hơn so với những năm đầu phát triển của bệnh HIV
|
Giai đoạn |
Tình trạng bệnh nhân |
| Giai đoạn 1: Nhiễm HIV cấp tính | Lượng lớn virus HIV trong máu, rất dễ lây lan
Triệu chứng giống như cúm |
| Giai đoạn 2: Nhiễm HIV mạn tính | Giai đoạn nhiễm HIV không triệu chứng / tiềm ẩn lâm sàng
Virus HIV hoạt động mạnh và tiếp tục sinh sản trong cơ thể Virus HIV có thể lây lan Nếu được điều trị tốt, bệnh nhân không chuyển sang giai đoạn 3 |
| Giai đoạn 3: Hội chứng suy giảm miễn dịch mắc phải (AIDS) | Giai đoạn nặng nhất
Lượng virus HIV trong cơ thể cao và dễ lây truyền nhất Hệ thống miễn dịch bị tổn thương nghiêm trọng Mắc nhiều bệnh nhiễm trùng cơ hội |
(cái này nên viền bảng nè – tại bên preview sợ nó bị kì í)
1.4 Các loại virus HIV?
Virus gây suy giảm miễn dịch ở người (HIV) trên thực tế có 2 loại HIV: HIV-1 và HIV-2. HIV-1 là loại phổ biến nhất và có khoảng 95% người nhiễm HIV trên toàn thế giới. HIV-1 là một loại retrovirus có nguồn gốc từ tinh tinh và được truyền sang người. Có 4 nhóm HIV-1: M, N, O và P. Nhóm M lớn nhất và chia thành 9 loại phụ. Trong đó, loại phụ B là loại phổ biến nhất ở Hoa Kỳ. Khi một người nhiễm HIV-1, virus bắt đầu lây nhiễm một loại tế bào miễn dịch cụ thể gọi là CD4.
1.5 HIV-1 được chẩn đoán như thế nào?
Có một số xét nghiệm được thực hiện để chẩn đoán HIV-1 thông qua mẫu máu được lấy từ tĩnh mạch ở cánh tay hoặc vết chích ở ngón tay
- Xét nghiệm kháng thể
- Xét nghiệm kháng nguyên / kháng thể: tìm kháng thể kháng HIV (protein virus p24)
- Xét nghiệm Acid nucleic (NAT)
1.6 Nguyên nhân gây ra HIV-1?
Có một số chất dịch cơ thể có thể truyền HIV-1 bao gồm: máu, tinh dịch, dịch trước tinh dịch, dịch trực tràng, dịch âm đạo, sữa mẹ
Một số cách lây truyền HIV-1 phổ biến như tái sử dụng hoặc sử dụng chung tiêm chích ma túy, quan hệ tình dục qua đường hậu môn hoặc âm đạo, người mẹ không được điều trị bằng thuốc sang thai nhi hoặc cho con bú
2.Tìm hiểu chung về Lenacapavir
Vào năm 2022, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã phê duyệt Sunlenca (Lenacapavir), một loại thuốc kháng virus dành cho bệnh nhân trưởng thành mắc virus gây suy giảm miễn dịch ở người loại 1 (HIV-1). Sunlenca là thuốc đầu tiên thuộc nhóm thuốc mới được gọi là thuốc ức chế capsid được FDA chấp thuận để điều trị HIV-1. Tính an toàn và hiệu quả của Sunlenca đã được thiết lập thông qua thử nghiệm lâm sàng với 72 bệnh nhân bị nhiễm HIV kháng nhiều loại thuốc. Những bệnh nhân này phải có lượng virus cao trong máu mặc dù đang dùng thuốc kháng virus. Bệnh nhân được ghi danh vào một trong hai nhóm nghiên cứu: nhóm đầu tiên được chọn ngẫu nhiên để nhận Sunlenca hoặc giả dược theo kiểu mù đôi và nhóm còn lại biết rõ loại thuốc được sử dụng. Thước đo chính về hiệu quả là tỷ lệ bệnh nhân trong nhóm nghiên cứu ngẫu nhiên đạt được mức giảm virus nhất định trong 14 ngày đầu so với ban đầu. Trong nhóm này, 87,5% bệnh nhân dùng Sunlenca đạt được mức giảm virus so với 16,7% bệnh nhân dùng giả dược.
2.1 Nhóm dược lý và chỉ định sử dụng
Lenacapavir là chất ức chế capsid đầu tiên được phê duyệt để sử dụng trong điều trị HIV-1. Lenacapavir kết hợp với các thuốc kháng virus khác được chỉ định để điều trị nhiễm virus gây suy giảm miễn dịch ở người đa kháng thuốc loại 1 (HIV-1) ở người trưởng thành đã từng điều trị nặng, những người không dung nạp thuốc
2.2 Cơ chế hoạt động
HIV-1 kết hợp nhiều yếu tố vật chủ khác nhau trong chu kỳ sao chép, bao gồm trong quá trình xâm nhập tế bào chủ, tích hợp nhân, sao chép và lắp ráp virion. Sau sự hợp nhất ban đầu với màng tế bào chủ, capsid của virus được giải phóng vào tế bào chất của tế bào chủ. Capsid bao gồm khoảng 250 hexamer và chính xác là 12 pentamer, mỗi pentamer bao gồm các protein capsid đơn phân (CA). Mỗi monome CA bao gồm hai miền đầu cuối N và đầu cuối C (NTD/CTD) và cung cấp bề mặt mà các phân tử khác của virus có thể tương tác với các tế bào chủ của cơ thể. Để tạo điều kiện thuận lợi cho việc tích hợp bộ gen của HIV-1, capsid sử dụng phức hợp lỗ nhân (NPC). Hai protein chủ cần thiết cho sự xâm nhập hạt nhân capsid liên kết trực tiếp với capsid, cả hai protein liên kết cùng một túi liên kết phenylalanine-glycine giữa NTD và CTD của các đơn phân CA lân cận trong các tổ hợp CA đa phân tử. Lenacapavir chứa một vòng difluorobenzyl và có cấu trúc tinh thể liên kết với các hexamer CA. Từ đó làm gián đoạn tương tác giữa capsid với CPSF6 và Nup153 một cách cạnh tranh. Ở nồng độ rất thấp, Lenacapavir ức chế sự xâm nhập của nhân virus trong khi ở nồng độ cao hơn còn ức chế quá trình tổng hợp DNA của virus và sao chép ngược
2.3 Dược động học
Hấp thu: Sau khi tiêm dưới da, Lenacapavir được giải phóng chậm nhưng được hấp thu hoàn toàn với nồng độ đỉnh trong huyết tương đạt được sau 84 ngày dùng thuốc. Sinh khả dụng tuyệt đối sau khi uống chỉ khoảng 6 – 10%. Tmax sau uống khoảng 4 giờ và Cmax là 97,2 ng/mL ở cả đường uống và đường tiêm dưới da
Phân bố: Thể tích phân bố (Vd) là 976L ở những bệnh nhân nhiễm HIV-1 đã từng được điều trị. Lenacapavir liên kết với protein huyết tương khoảng 99,8%
Chuyển hóa: Lenacapavir được oxy hóa qua enzyme CYP3A4 và UGT1A1 và trải qua các quá trình N-dealkyl hóa, hydro hóa, thủy phân amit, glucuronid hóa, liên hợp hexose, liên hợp pentose và liên hợp glutathione
Thải trừ: 76% liều đơn Lenacapavir được thải trừ qua phân và < 1% qua nước tiểu với thời gian bán hủy (T1/2) từ 10 – 12 ngày sau khi uống và từ 8 – 12 tuần sau tiêm dưới da. Độ thanh thải (Cl) Lenacapavir là 3,62L/giờ ở những bệnh nhân nhiễm HIV-1 đã từng được điều trị
2.4 Tác dụng phụ
Lenacapavir có thể gây ra tác dụng phụ. Một số tác dụng phụ phổ biến như buồn nôn, chóng mặt khi dùng đường uống và các tác dụng phụ khác là phản ứng tại chỗ tiêm: đau, ngứa, sưng, đỏ, đau hoặc khó chịu, ngứa, da cứng lại hoặc khối hoặc cục nhỏ
3.Kết luận
Tổng kết lại, việc chấp thuận Lenacapavir là một loại thuốc ức chế capsid đã mở ra những triển vọng mới trong việc điều trị HIV-1. Nhờ vào cơ chế hoạt động khác biệt so với các loại thuốc HIV-1 hiện có, Lenacapavir có khả năng giảm đáng kể mật độ virus HIV-1 trong huyết thanh và có thể chống lại các biến thể kháng thuốc của HIV-1. Điều này điều trị để mang đến cuộc sống tốt hơn cho những bệnh nhân bị mắc HIV-1.
Leave a Reply