Xương lành mạnh và đầy đủ là điều kiện cần thiết để đặt implant đạt chức năng và thẩm mỹ. Nếu không thỏa mãn điều kiện này, cần chỉ định ghép xương trước khi đặt implant. Thủ thuật ghép sẽ phụ thuộc vào mức độ phức tạp của thiếu hổng. Bài viết này chủ yếu đề cập đến vấn đề chuẩn bị vị trí cấy ghép đối với tái tạo xương có hướng dẫn, đồng thời sơ lược về các loại màng sử dụng trong quá trình này. Cùng tìm hiểu.
1. Khái niệm về chuẩn bị vị trí cấy ghép
Mô cứng và mô mềm thường cần được “chuẩn bị” (tái tạo/phục hồi) để cho phép đặt implant vào vị trí lý tưởng về chức năng lẫn thẩm mỹ với đủ xương đủ nâng đỡ [4]. Có nhiều loại khiếm khuyết mô cứng, với mức độ phức tạp khác nhau, bao gồm thiếu hồng xương theo chiều ngang hoặc chiều đứng hoặc cả hai [1]. Quy trình ghép để chuẩn bị vị trí cấy ghép thường thay đổi tùy theo mức độ phức tạp của thiếu hổng. Có nhiều loại vật liệu ghép khác nhau với những tính chất sinh học khác nhau. Những tính chất này cùng với các yếu tố toàn thân và yếu tố môi trường tại chỗ có thể ảnh hưởng đến kết quả ghép [4]. Khiếm khuyết mô mềm lớn được kiểm soát dễ dàng trước khi đặt implant, còn những khiếm khuyết nhỏ có thể được giải quyết vào thời điểm đặt implant [4].
Xương lành mạnh và đầy đủ là điều kiện cần thiết để đặt implant đạt chức năng và thẩm mỹ. Nếu không thỏa mãn điều kiện này, cần chỉ định ghép xương trước khi đặt implant [4]. Thủ thuật ghép sẽ phụ thuộc vào mức độ phức tạp của thiếu hổng. Tái tạo xương có hướng dẫn GBR là một kỹ thuật phổ biến, trong đó sử dụng màng ngăn để ngăn cách vị trí ghép khỏi mô mềm phía trên. Kéo giãn xương (distraction osteogenesis) và nâng xoang cũng lần lượt được SỬ dụng để cải thiện chiều rộng và chiều cao của sống hàm bị khiếm khuyết [4].
2. Tổng quan về các loại màng ngăn sử dụng trong quá trình tái tạo xương có hướng dẫn (GBR)
Tái tạo xương có hướng dẫn GBR và kỹ thuật ghép ban đầu sử dụng màng lọc (giấy) Millipore không phù hợp với thực tế [5]. Màng polytetrafluoroethylene lần đầu tiên được sử dụng vào năm 1984 và được xem là tiêu chuẩn cho GBR [6] với kết quả tuyệt vời. Loại màng không tiêu này phải được lấy ra vào lần phẫu thuật thứ hai vào thời điểm 4-6 tuần sau lần phẫu thuật thứ nhất. Thông thường, màng không tiêu có thể bị lộ trong thời gian lành thương và bị nhiễm, dẫn đến phải lấy ra sớm, từ đó ảnh hưởng đến kết quả tái tạo. Màng tiêu được phát triển để khắc phục các hạn chế này [5]. Những màng này có thể có nguồn gốc động vật hoặc polymer tổng hợp. Chúng dần dần bị thủy phân hoặc bị enzyme phân hủy [7], và do đó, không cần phẫu thuật thì hai để lấy màng ra. Nguồn gốc của chúng rất đa dạng, trong giai đoạn đầu là collagen bò, polylactic acid, polyglycolide, Vicryl, da nhân tạo, và màng cứng đông khô. Màng tổng hợp được phát triển gần đây thường kết hợp nhiều loại vật liệu [8].
Màng collagen thường được sử dụng trong GBR, và là collagen loại I hoặc II có nguồn gốc từ bò hoặc lợn. Chúng thường liên kết chéo và tiêu sau 4 đến 40 tuần tùy loại. Màng tiêu collagen không cần phẫu thuật để lấy ra. Những màng này ngăn cản sự di chuyển tăng sinh của tế bào biểu mô, ổn định vật liệu ghép hạt, và ngăn ngừa mất máu bằng cách kích thích sự kết dính tiểu cầu để hình thành cục máu đông sớm và ổn định vết thương [5, 6]. Những màng này còn có thể tạo thuận lợi cho sự đóng kín vết thương ban đầu nhờ tính chất hóa hướng động nguyên bào sợi [6].
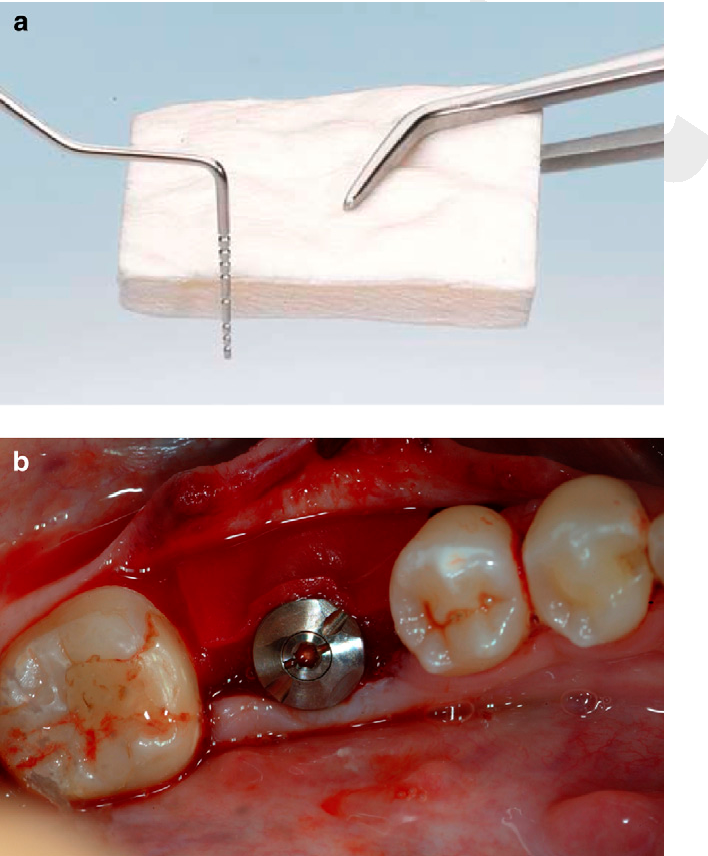
Một vấn đề cần xem xét sau khi chuẩn bị vị trí cấy ghép là cần thời gian lành thương bao lâu trước khi tiến hành đặt implant. Kết hợp vật liệu ghép vào vị trí nhận và sự tạo xương sống tại vị trí này cần khoảng thời gian khác nhau. Một số nghiên cứu cho rằng nên chờ 4-6 tháng trước khi đặt implant. Tuy nhiên, thời gian lành thương sau khi chuẩn bị trí cấy ghép còn thay đổi phụ thuộc nhiều yếu tố, chẳng hạn như yếu tố bệnh nhân (thói quen, tình trạng toàn thân), vật liệu ghép được sử dụng, và kích thước của vị trí ghép [9, 10]. Tuy nhiên, một số nghiên cứu khác cho thấy implant có thể được đặt cùng lúc ghép (phẫu thuật một thì) nếu có đủ xương để tạo ra độ ổn định implant sơ khởi.
Nguồn tài liệu: Clinical Cases in Implant Dentistry, First Edition – Published 2017 by John Wiley & Sons, Inc.
1. Lindhe JKT. Clinical Periodontology and Implant Dentistry, 4th edn. Hoboken, NJ: Wiley-Blackwell; 2003.
2. Seibert JS, Salama H. Alveolar ridge preservation and
reconstruction. Periodontol 2000 1996;11:69-84. 3. Miller Jr PD. Periodontal plastic surgery. Curr Opin Periodontol 1993:136-143.
4. American Academy of Periodontology. Guidelines for management of patients with periodontal disease. J Mich Dent Assoc 2006;88(10):24.
5. Miller N, Penaud J, Foliguet B, et al. Resorption rates of 2 commercially available bioresorbable membranes. A histomorphometric study in a rabbit model. J Clin Periodontol 1996;23(12):1051–1059.
6. Juodzbalys G, Raustia AM, Kubilius R. A 5-year follow- up study on one-stage implants inserted concomitantly with localized alveolar ridge augmentation. J Oral Rehabil 2007;34(10):781-789.
7. Duskova M, Leamerova E, Sosna B, Gojis O. Guided tissue regeneration, barrier membranes and reconstruction of the cleft maxillary alveolus. J Craniofac Surg 2006;17(6):1153-1160.
8. Wang HL, Boyapati L. “PASS” principles for predictable bone regeneration. Implant Dent 2006;15(1):8-17.
9. Chen ST, Wilson Jr TG, Hämmerle CH. Immediate or early placement of implants following tooth extraction: review of biologic basis, clinical procedures, and outcomes. Int J Oral Maxillofac Implants 2004;19(Suppl):12-25.
10. Bell RB, Blakey GH, White RP, et al. Staged reconstruction of the severely atrophic mandible with autogenous bone graft and endosteal implants. J Oral Maxillofac Surg 2002;60(10):1135-1141.
Leave a Reply