Chỉ định điều trị phẫu thuật được đặt ra khi điều trị nội khoa kết hợp vật lý trị liệu không còn hiệu quả. Những phẫu thuật can thiệp tối thiểu được quan tâm và ưu tiên thực hiện khi có chỉ định, đặc biệt trên nhóm bệnh nhân trẻ tuổi. Đối với phẫu thuật xâm lấn, thay khớp gối là phương pháp được áp dụng phố biến. Tại Mỹ, hằng năm có trên 300 nghìn khớp gối được thay, và con số này ngày càng tăng lên đồng thời với mức độ già hóa của dân số Mỹ [28],[29]
1. Nội soi làm sạch (Arthroscopic lavage and debridement)
Rửa khớp gối là phương pháp dùng dung dịch nước muối sinh lý đế bơm rửa khớp gối qua ống trocart. Rửa khớp gối được Burman thực hiện đầu tiên năm 1934 [30], về lý thuyết, rửa khớp có thể cài thiện lâm sàng nhờ loại bỏ được các mảnh dị vật nhỏ do quá trình bào mòn của sụn khớp gây ra, loại bỏ các cytokines gây viêm màng hoạt dịch. Tuy nhiên, tình trạng lâm sàng chỉ cải thiện trong thời gian rất ngắn, vì bản thân tổn thương sụn không được giải quyết [31], Đến năm 1941, Magnusoti thực hiện nội soi làm sạch, nghĩa là qua nội soi, đồng thời với rửa khớp, dùng dụng cụ cắt lọc tổ chức viêm bao hoạt dịch, lấy bỏ các dị vật khớp gối do mảnh sụn vỡ bong ra (loose bodies), cắt bò các gai xương rìa khớp (osteophytes) và các kén khớp (kén Baker) [32], Đối với những mảnh sụn khớp còn bám nhưng mất vừng, có nguy cơ bong gãy gây dị vật về sau cũng được lấy bỏ. Sụn chêm rách do thoái hóa được xử lý. Những khớp gối thoái hóa nặng, tổ chức xương dưới sụn gồ ghề, được mài nhẵn. Nội soi làm sạch giúp bệnh nhân thoái hóa khớp gối cải thiện được lâm sàng trong một thời gian nhất định, đặc biệt là dấu hiệu kẹt khớp, tiếng lục cục khớp cơ bản được giải quyết. Nội soi làm sạch khớp được chi định cho bệnh nhân thoái hóa gối giai đoạn 2, 3, điều trị nội khoa không kết quả nhưng chưa có chỉ định hoặc chưa thể phẫu thuật thay khớp [47]. Tuy nhiên, đến nay vẫn còn nhiều tranh luận về hiệu quả của nội soi làm sạch khớp, phần lớn tác giả đều nhận định, hiệu quả của phương pháp này là không rõ ràng. Moseley chứng minh rằng, không có sự khác biệt về hiệu quả lâm sàng của nhóm bệnh nhân được điều trị bàng rửa khớp đơn thuần hoặc rửa khớp kết hợp cắt lọc làm sạch khớp khi so sánh với nhóm chửng[33]. Livesley (1991) và hầu hết các tác giả cùng khẳng định nội soi rửa, làm sạch khớp trong điều trị thoái hóa khớp gối hầu như không mang lại hiệu quả giảm đau lâu dài [34].
2. Kích thích tủy xương qua nội soi (Arthroscopic bone marrow stimulation)
Kích thích tủy xương qua nội soi bằng cách gây tổn thương chảy máu vùng xương dưới sụn nhằm mục đích tạo ra các sợi fibrin bám dính trên bề mặt vùng khuyết sụn. Các tế bào chưa biệt hóa từ dịch tủy xương (trong đó có nguyên bào sụn) trôi ra, bám dính vào các sợi fibrin, cùng với sự tham gia của các yếu tố tăng trưởng tại chỗ (Growth Factors), trải qua quá trình sẹo hóa, lớp sụn xơ (fibrocartilage) được tạo thành, che phủ vùng khuyết sụn. Quá trình này đã được chứng minh do vai trò của TBG và các yếu tố phát triển có mặt trong dịch tủy xương sau kích thích và được gọi chung là phương pháp kích thích tủy xương {Bone Marrow Stimulation) [35]. Tuy nhiên, qua nghiên cứu trên động vật thực nghiệm, lớp sụn xơ tạo ra sau kích thích tủy xương, về cấu trúc vi thể không giống như lớp sụn trong bình thường (hyaline cartilage) ở chỗ kém bền vững, dễ bị bong gày. Khi soitrên kính hiển vi quang học thấy trong cấu trúc của sụn xơ có sổ lượng tế bào sụn (chondrocyte) nam rải rác, thưa thớt, tập trung chủ yếu là mô đệm giàu sợi xơ. Trong khi đó, trên tiêu bản sụn trong, số lượng tế bào sụn tập trung với mật độ cao hơn, mô đệm giàu sợi collagen type II [35],
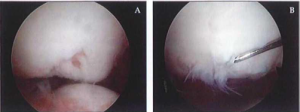
3. Nội soi kích thích tạo tổn thương dưới sụn (Microfractures-MF)
Đây là một kỹ thuật kích thích tủy xương, dược Steadman và cộng sự mô tả năm 1997 [36]. Qua nội soi gối, các vùng khuyết sụn được làm sạch, để lộ xương dưới sụn. Những phần sụn còn bám nhưng mất vững được lấy bở đến vùng sụn lành, dùng dùi đầu nhọn hoặc khoan tạo nhiều lỗ trên nền xương dưới sụn cho đến chảy máu và dịch tủy xương (Hình 2.5-A,B). Các lỗ này cách nhau 3-4 mm (3-4 lồ trên một em2), sâu khoảng 4 mm. Sau mổ, gối có thể tập gấp duỗi bình thường, nhưng không tỳ trong vòng 4-6 tuần. Nhiều nghiên cứu đã tiến hành nội soi kiểm tra (second look) sau 8-12 tháng (Hình 2.5-C), qua đó sinh thiết làm mô bệnh học thấy rang vùng sụn mới hình thành chủ yếu là sụn xơ (fibrocartilage) [37].
MF là một kỹ thuật điều trị thoái hóa khớp gối không quá phức tạp, dễ thực hiện, chi phí thấp, áp dụng chủ yếu cho những thoái hóa khớp gối thứ phát sau chấn thương, có vùng khuyết sụn nho (< 4cm2), thường gặp ở người trẻ. Steadman (2003) thông báo có 80% của 70 khớp gối được thực hiện kỹ thuật này có cải thiện được lâm sàng, đặc biệt là triệu chứng đau và biên độ vận động của khớp [38], Kreuz (2006) và cộng sự lại thấy rằng, trong số 85 bệnh nhân sau mo MF, sự cải thiện lâm sàng chi kéo dài được 1 tháng. Đối với nhóm bệnh nhân trẻ dưới 40 tuổi, tình trạng cải thiện lâm sàng tốt hơn [39]. Đồng thời với MF thì phương pháp cấy ghép tế bào sụn đã được nghiên cứu và ứng dụng. Một thống kê được Harris thực hiện năm 2010 dựa trên 7 kết quả nghiên cứu tù’ năm 2004-2010 của các tác giả Basad, Kunutsen, Saris, Kohti khi so sánh MF với ghép tế bào sụn tự thân thấy kết quả lâm sàng được cải thiện có xu hướng nghiêng về ghép tế bào sụn tự thân [39].
4. Ghép tế bào sụn tự thân (Autologous Chondrocyte Implantation-ACI)
Phương pháp ACI được Brittberg mô tả đầu tiên vào năm 1994 [40], Theo đó, tế bào sụn sau khi được lấy từ mô sụn của chính bệnh nhân qua nội soi khớp, được nuôi cấy trong môi trường nhân tạo giàu dinh dưỡng và giàu các yếu tố tăng trưởng, trong thời gian 3-4 tuần để được tăng sinh. Khối tế bào sụn sau khi tăng sinh (khoảng
triệu tế bào) được trộn lẫn trong huyễn dịch trung tính hoặc huyền dịch chứa nhiều collagen, được ghép trở lại vào vùng khuyết sụn qua mớ khớp gối [41]. Khối tế bào được cố định bằng màng xương lấy từ xương chày của bệnh nhân.
Quá trình thực hiện kỹ thuật này được tóm tắt thành 5 bước như sau:
- Bước 1: Nội soi khớp, lấy mô sụn lành tại vị trí không tỳ đè
- Bước 2: Nuôi cấy để tăng sinh
- Bước 3: Mở khớp gối làm sạch vùng khuyết sụn
- Bước 4: Lấy màng xương từ xương chày, khâu phủ bề mặt vùng khuyết sụn.
- Bước 5: Bơm huyễn dịch chứa tế bào sụn sau nuôi cấy vào dưới màng xương.
Phương pháp này chỉ nên áp dụng cho những bệnh nhân trẻ tuổi, có tổn thương sụn mới và một vị trí với diện tích vùng khuyết sụn vừa [41].
Ưu điểm của phương pháp: phục hồi được lớp sụn mới có bản chất là sụn trong (hyaline cartilage), có tính đàn hồi, tính bền vững cao, giống sụn bình thường
Nhược điểm của phương pháp; bệnh nhân phải trải qua hai lần phẫu thuật, đặc biệt lần ghép tế bào sụn phải mở khớp gối. Mặt khác tế bào sụn phải nuôi cấy trong môi trường đặc biệt với giá thành cao, làm tăng chi phí điều trị. Khối tế bào sụn được nhân lên từ các tế bào sụn trưởng thành nên nhanh lão hóa, thiếu ổn định. Ngay sau ghép, mảnh ghép dễ bị bong khỏi vị trí ghép, dẫn đến thất bại[42]. Ghép xương sụn hoặc ghép tế bào sụn đều phải lấy một phần sụn lành, gây vùng tổn thương mới trong khớp. Ngoài ra bản thân sụn ghép không giữ được cấu trúc nguyên thủy ban đầu, sự phản ứng tại vùng giáp ranh giữa sụn ghép (cho) và lành (nhận) vẫn đang là một thách thức.
5. Phẫu thuật ghép xương sụn tự thân hoặc đồng loại (Osteochondral Autograft/ Autograft Transplantation – OAT)
Nếu ghép phần sụn (hyaline cartilage) đơn thuần sẽ không tạo được sự liền sụn tại vị trí giáp ranh giữa mảnh ghép và sụn lành (do sụn không có mạch nuôi). Để khắc phục nhược điểm đó, ghép xương sụn- mảnh ghép bao gồm phần xương liền sụn, sẽ tạo được sự liền xương tại vị trí ghép, nhờ đó sụn ghép sống và vần đảm bảo được chức năng của sụn. OAT được Matsusue mô tả đầu tiên năm 1993. OAT được áp dụng cho những tổn thương sụn có diện tích nhỏ và vừa (1 -4cm2), đơn ổ. Sụn ghép được lấy từ sụn lành ở vị trí không tỳ đè của chính bệnh nhân (tự thân) hoặc của người cho (đồng loại) [43]. Mánh glico hình trụ, bao gồm phần xương liền sụn, được nêm chặt vào vị trí khuyết sụn, tạo ra bề mặt sụn giống sụn lành (Hình 2.7). OAT có thể được tiến hành qua nội soi hoặc mổ mở. Nhược điểm chính của OAT là tạo tổn thương mới tại vị trí lấy sụn đối với ghép tự thân. Neu ghép đồng loại, liên quan đến vấn đề xử lý mảnh ghép và thải ghép. Trong thời gian chưa liền xương, mảnh ghép dễ rơi vào khớp gây kẹt khớp khi bệnh nhân vận động.
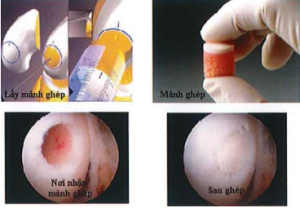
Năm 2003, Handy báo cáo với số lượng bệnh nhân lớn hơn, gồm 597 lồi cầu đùi, 76 mâm chày và 118 diện khớp chè đùi được ghép xương sụn, thời gian theo dõi sau mổ gần 10 năm, tỷ lệ tốt và rất tốt chiếm lần lượt 92%, 87% và 79% [45].
Mặc dù kết quả cải thiện lâm sàng được khẳng định, tuy nhiên cả ba phương pháp MF, AC1 và OAT đều chỉ được áp dụng trên bệnh nhân trẻ tuổi, chủ yếu là thoái hóa khớp gối thứ phát sau chấn thương, diện tích vùng khuyết sụn nhỏ và đơn ổ [45],
6. Ghép tế bào gốc (TBG)
Một số phương pháp đã đề cập Ư trên như ghép tế bào sụn tự thân (ACI), ghép xương sụn tự thân hoặc đồng loại (OAT), Microữacture (MF) đều chỉ áp dụng cho THKG thứ phát sau chấn thương, có tổn thương khuyết sụn trên diện tích hẹp, một vị trí, ở người trẻ tuổi. Đối với THKG nguyên phát, tổn thương sụn khớp thường xảy ra trên diện tích rộng, có thể ở nhiều vị trí, ở người có tuổi. Phương pháp nội soi khớp đe rửa, cắt lọc và làm sạch các khoang khớp gối đã được áp dụng. Tuy nhiên, theo kết quả của nhiều nghiên cứu cho thấy, nội soi làm sạch khớp đơn thuần không mang lại hiệu quả đáng kể [3 1 ],[33]. Hướng nghiên cứu dùng TBG để sửa chữa, tái tạo sụn khớp bị tổn thương do thoái hóa, đà được tiếp cận từ những năm đầu của thập niên 90 [46].
Với đặc tính có khả năng tự tái tạo và biệt hóa thành những tế bào chuyên biệt, đa dòng trong những điều kiện nhất định, TBG được xem như là nguồn “nguyên liệu dự trữ”, giúp cơ thế sửa chữa, tái tạo, thay thế những mô, tổ chức bị tổn thương hay già hóa, trong đó có sụn khớp [46],[47], Hướng ứng dụng, ghép TBG thành công, sổ mở ra một triển vọng mới trong điều trị THKG cả nguyên phát và thứ phát, giúp người bệnh đẩy lùi được thời gian phải thay khớp hoặc tránh được cuộc phẫu thuật thay khớp vốn nhiều rủi ro và tốn kém.
7. Phẫu thuật đục xương chỉnh trục (Osteotomy)
Mục đích của đục xương sửa trục là làm thay đổi trục cơ học hay trục chịu lực của chi dưới, chuyển trọng tâm chịu lực của khớp gối từ khoang thoái hỏa sang khoang lành theo trục sinh lý, làm giảm tải lên bề mặt khớp đã thoái hoá, giúp bệnh nhân giảm đau cho tới khi vùng sụn mới bị mòn [48], Đục xương sửa trục thường được chỉ định đế điều trị những thoái hoá khớp gối sớm, một khoang (khoang trong hoặc khoang ngoài của khớp), thường gặp ở bệnh nhân có biển dạng chân kiểu vẹo trong (chân chữ O) hay vẹo ngoài (chân chữ X-hai bên, chữ K-một bên). Vị trí đục xương có thể ở mâm chày hoặc trên lồi cầu đùi, đục theo hình thức “V đóng” hoặc “V mở”. Đối với chân vẹo trong (thoái hóa khoang trong), có thể đục xương kiểu “V đỏng” ở phía ngoài hoặc kiểu “V mở” ở phía trong mâm chày. Theo kinh điển, thường đục kiểu “V đóng” phía ngoài mâm chày, đồng thời đục cả xương mác hoặc tạo hình lại khớp chày mác trên cùng bên. Tuy nhiên nhược điểm của kỹ thuật này là dễ gặp tai biến liệt thần kinh mác chung do tác động đến đầu trên xương mác. Theo Staubli (2003), tỷ lệ gặp tai biến này là 11%. MỘT mối quan tâm nữa đó!à sự thay đổi trục khi đục xương kiểu V đóng phía ngoài có thể làm thay đổi bình diện khớp chè đùi. Sự mất xương cũng gây ra một thách thức cho vấn đề thay khớp về sau. Trước những nhược điểm này, đục xương phía trong mâm chày kicu V mở ngày nay được lựa chọn phổ biến hơn khi điều trị thoái hóa khoang trong do trục chi vẹo trong [49].
Từ năm 1961, Jackson và cộng sự đã chứng minh được hiệu quả giảm đau sau khi thay đổi trục cơ học của khớp ở bệnh nhân vẹo trục chi. Tuy nhiên nhiều tác giả khác (Harris 1970) nghi ngờ kết quả này và cho rằng, nguyên nhân gây đau trong vẹo trục chi không hoàn toàn do thay đổi trục cơ học [50], Phương pháp đục xương sửa trục được chỉ định rộng rãi cho điều trị thoái hóa khớp gối từ những năm 1960 đến những năm 1970. Khi theo dõi lâu dài trên những bệnh nhân được thay khớp gối với tỷ lệ thành công cao, phương pháp này sau đó ít được chỉ định phổ biến. Một ưu điểm của đục xương sửa trục vượt trội hơn so với thay khớp là bảo tồn được xương quanh gối, giữ được cấu trúc bên trong cũng như hệ thống dây chằng bên ngoài của khớp. Do vậy, với bệnh nhân trẻ tuổi, thoái hóa khớp một khoang có liên quan đến lệch trục chi, đục xương sửa trục vẫn là một chỉ định phù hợp [49],[50].
8. Phẫu thuật thay khớp gối
Thay khớp là một phương pháp điều trị triệt để, bệnh nhân sớm lấy lại được chức năng vận động của khớp gối sau mổ. Tuy nhiên, ihay khớp là một phẫu thuật lớn, tiềm ẩn nhiều rủi ro hơn, giá thành cao, không phải bệnh nhân nào cũng đáp ứng được điều kiện thay khớp. Hơn nữa tuổi thọ của khớp nhân tạo chỉ có thời hạn nhất định, nên ở những bệnh nhân thuộc nhỏm trẻ tuổi (< 55) phải đứng trước nguy cơ thay lại khớp (revision) nhiều lần, nhất là tuổi thọ trung bình của con người ngày càng tăng. Vì vậy, chỉ định phẫu thuật thay khớp gối phải xét trên nhiều khía cạnh, như mức độ thoái hóa, tuổi, khả năng đáp ứng với các phương pháp điều trị khác…[51]. Thay khớp gối có thể thay 1 khoang trong hoặc khoang ngoài hoặc thay khớp gối toàn bộ.
TÀI LIỆU THAM KHẢO
- Trần Ngọc Ân (1995). Hư khớp và hư cột sống, bệnh thấp khớp. NXB Y học: tr.I93-209
- Mankin, H.B.J. (1974). The reaction of articular cartilage to injury and osteoarthritis Part II. New England Journal of Medicine; 291, 1335—40.
- David J. Samson, M.S. Mark D. (2007), Treatment of Primary and Secondary Osteoarthritis of the Knee. Evidence Report/Technology Assessment, Number 157.
- Felson DT, Lawrence RC, Dieppe PA, et al (2000). Osteoarthritis: new insights. Part 1: the disease and its risk factors. Ann Intern Med. Ỉ33(8):635“46
- Creamer p, Lethbridge Cejku M. Factors associated with functional impairment in symptomatic knee osteoarthritis. Rheumatology, 39(5), 490-496
- Coventry, M.B. (1965). Osteotomy of the upper portion of the tibia for degenerative arthritis of the knee: a preliminary report. Journal of Bone and Joint Surgery, American Volume, 47A, 984-90.p. 1124.
- Linda J Sandell, Thomas Aigner. (2001). Articular cartilage and changes in arthritis An introduction: Cell biology of osteoarthritis. Arthritis Res, 3:107 -113.
- Horton W.E, Bennion Jr. p, Yang L (2006). Cellular, molecular, and matrix changes in cartilage during aging and osteoarthritis. J Musculoskelet Neuronal Interact; 6(4):379-381.
- Radrigo Campos (2011). Assessment of reproducibility of the Outerbridge and FSA classifications for chondral lesions of the knee. Rev Bras Ortop 46(3):266-69.
- Mainil-Varletl T, Aigner A, Brittberg M, (2002). The International Cartilage Repair Society (ICRS) ‘Histological Visual Scale. European Cells and Materials; 4(1), 10.
- Hart D. J, Spector T. D (2003). Kellgren & Lawrence grade 1 osteophytes in the knee—doubtful or definite?. Osteoarthritis and Cartilage; 11, 149-150.
- KellgrenJ. H, Lawrence J. S(1957). Radiologic assessment of osteoarthritis, Ann. Rheum Dis\ vol. 16, pp. 494-501.
- Bruno c, Vande Berg (2002). Assessment of Knee Cartilage in Cadavers with Dual-Detector Spiral CT Arthrography and MR Imaging. Radiology, 222(2): tr. 430-435.
- Colton CL (1988). Magnetic Imaging of the knee. (Book review). J Bone Joint Surg;10-B\ 859.
- Recht MP, Resnick D (1994). MR imaging of articular cartilage: current status and future directions. AJR; 163: 283-290
- Dương Đình Toàn, Nguyễn Xuân Thùy (2014), “Điều trị thoái hóa khớp gối bằng phẫu thuật nội soi”, Phẫu thuật nội soi khớp gối, NX lì Y học, tr. 212-227,
- Livesley, P.J., Doherty, M., Needoff, M., and Moulton, A. (1991). Arthroscopic lavage of osteoarthritic knees. Journal of Bone and Joint Surgery, British Volume; 73B, 922-6.
- Dieuwke Schiphof, Mark de Niet (2011). Identifying Knee Osteoarthritis. The Netherlands Organization for Scientific Research, ISBN: 978-94-6169-194.
- Belo J. N, Berger M. Y.(2009). The prognostic value of the clinical ACR classification criteria of knee osteoarthritis for persisting knee complaints and increase of disability in general practice. Osteoarthritis Research Society International; 17, 1288-1292.
- Brett Levine, MD. Treatment Options for Osteoarthritis of the Knee. Clinician s Guide, AHRQ Pub. No. 09-EHC010-3.
- Robert T. Bashaw, PT (2005). Rehabilitation of the Osteoarthritic Patient: Focus on the Knee. Clin Sports Med; 24, 101 – 131.
- Choosing Pain Medicine for Osteoarthritis: A Guide for Consumers Agency for Healthcare Research and Quality, January 2007
- Yuanyuan Wang, Louise F (2004). The Effect of Nutritional Supplements on Osteoarthritis. Alternative Medicine Review; 9 (3), 275-291.
- Viscosupplementation for Osteoarthritis of the Knee, Rapid Review: Public March 17,2010
- Agency for Healthcare Research and Quality. Three treatments for osteoarthritis of the knee: Evidence shows lack of benefit. April 2009.
- Burnouf, T., Goubran, H. A.et al (2013). Blood-derived biomaterials and platelet growth factors ill regenerative medicine. Blood Reviews; 27 (2), 77-89.
- Tinsley, B. A., Ferreira, J. v.et al (2012). Platelet-Rich Plasma Nonoperative Injection Therapy-A Review of Indications and Evidence. Operative Techniques in Sports Medicine; 20 (2), 192-200.
- John C. Richmond (2008). Surgery for Osteoarthritis of the Knee. MDRheum Dis Clin N A; 34, 815-825
- Gupta S, Hawker GA, Laporte A (2005). The economic burden of disabling hip and knee osteoarthritis (OA) from the perspective of individuals living with this condition. Rheumatology, 44:153 i -1537.
- Chang, R.W, Falconer, J., Stulberg, S.D (1993). A randomised controlled trial of arthroscopic surgery versus closed needle joint lavage for patients with osteoarthrosis of the knee. Arthritis and Rheumatism, 36, 289-96.
- Dandy, D.J. (1991). Arthroscopic debridement of the knee for osteoarthritis (Editorial). Journal of Bone and Joint Surgery, British Volume, 73 B, 877-8.
- Dawes, P.T., Kirlew, C., and Haslock, I. (1987). Saline washout for knee osteoarthritis: results of a controlled study5C//m«j/ Rheumatology’, 6, 61-3.
- Moseley JB et al. (2002) A controlled trial of arthroscopic surgery for osteoarthritis of the knee. N Engl J Med 347: 81-88.
- Livesley, P.J., Doherty, M., Needoff, M., and Moulton, A. (1991). Arthroscopic lavage of osteoarthritic knees. Journal of Bone and Joint Surgery, British Volume; 73B, 922-6.
- Steinwachsl MR, Guggi Th (2008). Marrow stimulation techniques. Injury, Int. J. Care Injured; 39S1, S26 S31
- Peter F. Sharkey, MD (2010). Subchondral Bone Marrow Lesions Associated With Knee Osteoarthritis. A Case Report & Literature Review. Am J Orthop; 41 (9):413-417,
- Milhofer K, Williams RJ 3rd, Warren RF, et al (2005). The microfracture technique for the treatment of articular cartilage lesions in the knee. A prospective cohort study. J Bone Joint SurgAm; 87:1911 -20.
- Steadman JR, Kocher MS (2003). Outcomes of microfracture for traumatic chondral defects of the knee: average 11-year follow-up. Arthroscopy; 19:477-84.
- Steadman JR, Rodkey WG, Rodrigo JJ (2001). Microfracture: surgical technique and rehabilitation to treat chondral defects. Clin Orthop Relat Res; (391 Stihl):S362-9.
- Christian Ossendorfl, Matthias R Steinwachs (2011). Autologous chondrocyte implantation (AC1) for the treatment of large and complex cartilage lesions of the knee. Arthroscopy, Rehabilitation, Therapy & Technology>; 3:11
- Zeifang F, Oberle D, Nierhoff C, et al (2010). Autologous chondrocyte implantation using the original periostcura-cover technique versus matrix- associated autologous chondrocyte implantation: a randomized clinical trial. Am J Sports Med; 38(5):924-33.
- Peterson L, Brittberg M (2002). Autologous chondrocyte implantation: biomechanics and long-term durability. Am J Sports Med; 30:2-12
- Bugbee WD, Convert FR (1999). Osteochondral allograft transplantation. Clin Sports Med; 18:67-75.
- Aubin PP, Cheah HK, Davis AM, et al (2001). Long-term follow-up of fresh femoral osteochondral allografts for posttraumatic knee defects. Clin Orthop Relat Res; (391 Suppl): S318-27.
- Beaver RJ, Mahomed M, Backstein D, et al (1992). Fresh osteochondral allografts for post-traumatic defects in the knee. A survivorship analysis.,/ Bone Joint Surg Br; 74:105-110.
- Pittenger MF et al. (1999). Multilineage potential of adult human mesenchymal stem cells. Science 284; J43-147.
- Kolf CM et al. (2007) Mesenchymal stromal cells. Biology of adult mesenchymal stem cells: regulation of niche, self-renewal and differentiation. Arthritis Res Ther 9: 204.
- Coventry, M.B. (1965). Osteotomy of the upper portion of the tibia for degenerative arthritis of the knee: a preliminary report. Journal of Bone and Joint Surgery, American Volume, 47A, 984-90.P. 1124
- Coventry, M.B. (1987). Proximal tibial varus osteotomy for osteoarthritis of the lateral compartment of the knee. Journal of Bone and Joint Surgery, American Volume, 69A, 32-8.
- Gariepy, R. (1964). Genu valgum treated by high tibia! osteotomy. Journal of Bone and Joint Surgery, British Volume, 46B, 783
- Insall, J.N. (1996). Knee arthroplasty, then, now and tomorrow. In Current concepts in primary and revision total knee arthroplasty (ed. J.N. Insall, W.N. Scott, and G.R. Scuderi), pp. 1 -2. Lippincott-Raven, Philadelphia, PA
Leave a Reply