Bệnh Alzheimer là một trong những bệnh lão hóa thần kinh phổ biến nhất trên thế giới, ảnh hưởng đến hàng triệu người mỗi năm. Đây là một căn bệnh khó chữa và tiến triển chậm nhưng chắc chắn gây ra những tác động đáng kể đến chất lượng cuộc sống của bệnh nhân và người thân. Trong bài viết này, chúng ta sẽ tìm hiểu vềcơ chế bệnh sinh Alzheimer và điều trị.
1. Tổng quan bệnh Alzheimer
Alzheimer là bệnh sa sút trí tuệ tiến triển – do tế bào não thoái hoá tiến triển. Não bộ là trung tâm kiểm soát toàn bộ cơ thể và các vùng khác nhau của não bộ chịu trách nhiệm cho các hành vi khác nhau.
Hiện tượng não bộ thoái hóa xảy ra trong bệnh Alzheimer ảnh hưởng đến trí nhớ, kỹ năng tư duy, cảm xúc, hành vi và tâm trạng. Hậu quả là, khả năng thực hiện các hoạt động đời thường của người bệnh trở nên khiếm khuyết. Khi bệnh tiến triển, các triệu chứng trở nặng hơn.
2. Triệu chứng Alzheimer
Các triệu chứng đầu tiên của bệnh Alzheimer khác nhau ở mỗi người. Các vấn đề về trí nhớ thường là một trong những dấu hiệu đầu tiên của sự suy giảm nhận thức liên quan đến bệnh Alzheimer. Suy giảm nhận thức, chẳng hạn như khả năng tìm từ, các vấn đề về thị giác/không gian và suy giảm khả năng suy luận hoặc phán đoán, cũng có thể báo hiệu giai đoạn rất sớm của bệnh Alzheimer.
Một số người có thể được chẩn đoán mắc chứng suy giảm nhận thức nhẹ. Khi bệnh tiến triển, mọi người bị mất trí nhớ nhiều hơn và những khó khăn về nhận thức khác. Bệnh nhân có triệu chứng cơ năng và triệu chứng thực thể của sa sút trí tuệ.
Biểu hiện phổ biến ở giai đoạn nhẹ
Mất trí nhớ ngắn hạn (ví dụ: hỏi lặp đi lặp lại một câu, thường xuyên đặt sai đồ vật hoặc quên các cuộc hẹn)
Suy giảm khả năng lập luận, khó khăn trong giải quyết các công việc phức tạp, và khả năng đánh giá kém (ví dụ: không thể quản lý tài khoản ngân hàng, đưa ra các quyết định không đúng về tài chính)
Rối loạn chức năng ngôn ngữ (ví dụ: khó khăn trong việc suy nghĩ về những từ thông dụng, lỗi trong nói và/hoặc viết)
Rối loạn chức năng thị giác không gian (ví dụ: không có khả năng nhận dạng khuôn mặt hoặc các đồ vật thường gặp)
Biểu hiện phổ biến ở giai đoạn trung bình
Bệnh tiến triển nặng dần, rối loạn nhận thức đi kèm với các rối loạn hành vi:
+ Nhanh mất trí nhớ và lú lẫn .
+ Không có khả năng học những điều mới.
+ Khó khăn với ngôn ngữ và các vấn đề về đọc, viết và làm việc với các con số.
+ Khó tổ chức suy nghĩ và suy nghĩ một cách logic.
+ Khó thực hiện các nhiệm vụ nhiều bước, chẳng hạn như mặc quần áo.
+ Nhận dạng gia đình và bạn bè khó khăn.
+ Ảo giác, ảo tưởng và hoang tưởng.
+ Hành vi bốc đồng như cởi quần áo vào những thời điểm hoặc địa điểm không thích hợp hoặc sử dụng ngôn ngữ thô tục.
+ Tức giận bộc phát.
+ Bồn chồn, kích động, lo lắng, chảy nước mắt, đi lang thang — đặc biệt là vào buổi chiều muộn hoặc buổi tối.
+ Các câu nói hoặc cử động lặp đi lặp lại, thỉnh thoảng co giật cơ.
Biểu hiện phổ biến ở giai đoạn nặng
Không thể giao tiếp và hoàn toàn phụ thuộc vào sự chăm sóc của người khác. Vào giai đoạn nặng hơn, cơ thể có thể ngừng hoạt động, bệnh nhân nằm liệt giường.
+ Không có khả năng giao tiếp
+ Sụt cân
+ Co giật
+ Khó nuốt
+ Rên rỉ hoặc càu nhàu
+ Mất kiểm soát ruột và bàng quang
3. Cơ chế bệnh sinh của Alzheimer
APP
APP là protein gắn trên chuỗi nhẹ của kinesin-1, làm trung gian cho sự gắn kết các chất cần vận chuyển vào protein động cơ kinesin-1, ví dụ như bóng màng, các bào quan, các protein và tạo điều kiện thuận lợi cho sự vận chuyển các chất trên sợi trục tế bào thần kinh.
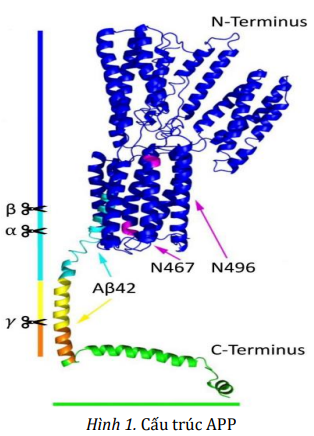
Về mặt cấu trúc, APP là một glycoprotein xuyên màng type I, chứa miền nội bào đầu C ngắn và miền ngoại bào lớn được bảo tồn cao. APP thuộc họ protein APP, trong nhóm này còn có APP-like protein 1 và 2 (cấu trúc tương đồng với APP nhưng không có Aβ). Gene APP nằm trên nhiễm sắc thể số 21, nó trải qua quá trình cắt nối thay thế 18 exon để cuối cùng tạo ra ba protein đồng dạng chính là APP 770, APP751 và APP695, trong đó APP 695 (dài 695 amino acid) có nhiều nhất trong não.
APP và các sản phẩm phân cắt của nó rất cần thiết cho sự phát triển bình thường của tế bào thần kinh. Ví dụ, Aβ và sAPP đều đóng góp vào các hoạt động sinh lý khác nhau; miền nội bào của APP (AICD) có thể hoạt động như một cofactor để kích hoạt phiên mã trong nhân, và nó được đề xuất là chất điều hòa chính trong sự hình thành, trưởng thành và hoạt động chức năng của synap thần kinh – cơ.
APP được tổng hợp trong lưới nội chất (ER) và sau đó được vận chuyển đến phức hợp Golgi, nơi nó hoàn thành quá trình trưởng thành và cuối cùng được vận chuyển đến màng sinh chất.
Phân cắt APP
APP trưởng thành trên màng sinh chất trải qua quá trình phân cắt gồm hai bước liên tiếp. Bước phân cắt đầu tiên chủ yếu được thực hiện bởi các alpha -secretase hoặc beta -secretase.
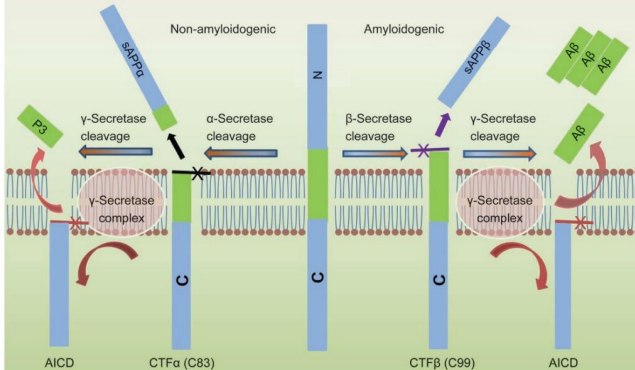
Trong con đường alpha – secretase (con đường non-amyloidogenic), nó bị phân cắt bởi một metalloproteinase ADAM 10 (thường được gọi chung là -secretase) giữa các gốc K16 và L17 ở vùng ngoại bào để tạo ra C83/CTF liên kết màng và sAPP.
Trong con đường beta – secretase (còn được gọi là con đường amyloidogenic), APP được phân cắt bởi beta-secretase tạo thành C99/CTF và sAPP.
Cả CTF và CTF tạo thành sau đó tiếp tục được xử lý bởi -secretase. -secretase là một phức hợp enzyme bao gồm 4 tiểu đơn vị: presenilin 1 hoặc 2, có chức năng như lõi xúc tác của phức hợp enzyme; presenilin enhancer 2, giúp ổn định phức hợp enzyme trưởng thành; anterior pharynx-defective 1, có chức năng lắp ráp phức hợp enzyme; và nicastrin, có chức năng nhận dạng cơ chất. Sự mất đi của bất kỳ tiểu đơn vị nào sẽ làm mất hoạt động phân giải protein của nó. -secretase phân cắt trong miền xuyên màng của CTF để tạo ra AICD cùng với p3 (trong con đường non-amyloidogenic) hoặc các Aβ có độ dài khác nhau (trong con đường amyloidogenic).
Beta amyloid (Aβ)
Chức năng sinh học
Aβ được biết đến nhiều nhất là peptide có liên quan đến cơ chế bệnh sinh của bệnh. Alzheimer. Tuy nhiên tai tiếng này đã làm lu mờ thực tế rằng Aβ phục vụ cho một số chức năng sinh lý quan trọng trong cơ thể. Aβ được tìm thấy trong tất cả các động vật có xương sống được nghiên cứu cho đến nay, tồn tại trong suốt vòng đời của cá thể, và trình tự phân tử của nó cho thấy mức độ bảo tồn cao. Những đặc điểm này ngụ ý nó phải mang đến ưu thế chọn lọc cho sự tồn tại của loài. Quan điểm này cũng được củng cố thêm bởi bằng chứng cho thấy sự cạn kiệt Aβ nội sinh gây ra những hậu quả bất lợi ở nhiều loài động vật khác nhau.
Cho đến nay, những vai trò được biết đến của Aβ bao gồm:
+ Hoạt động kháng khuẩn: Aβ có đặc tính kháng khuẩn, kháng nấm và kháng virus. Có hiệu quả chống lại ít nhất 11 loài vi khuẩn.
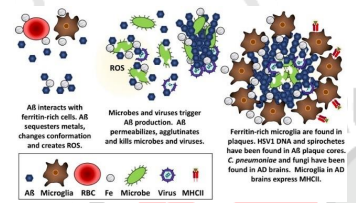
+ Ức chế khối u: Aβ có thể ngăn chặn virus gây ung thư và ức chế sự phát triển của khối u.
+ Ngăn chặn sự rò rỉ trong hàng rào máu não (BBB): Aβ liên kết các chất hòa tan trong máu với nhau để tạo thành một chốt chặn sự khuếch tán của các chất độc hại vào não.
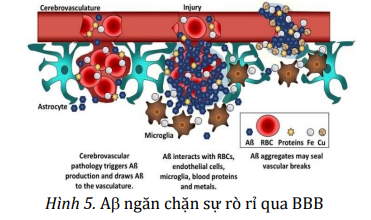
+ Thúc đẩy phục hồi sau chấn thương não: Sự hiện diện của Aβ mang lại kết quả tốt hơn ở các động vật mô hình về tác động lên vỏ não, tổn thương tủy sống, thiếu oxy và các bệnh tự miễn.
+ Điều chỉnh chức năng của synap thần kinh: Aβ điều chỉnh khả năng đáp ứng của các synap thần kinh glutamatergic và cholinergic ở hồi hải mã, góp phần củng cốtrí nhớ.
Các dạng cấu trúc của peptide Aβ
Aβ là tên gọi chung của một nhóm peptide có kích thước từ 37 đến 49 amino acid. Isoform 42 amino acid có trình tự được thể hiện ở hình bên dưới. Đây là dạng phổ biến nhất liên quan đến AD.
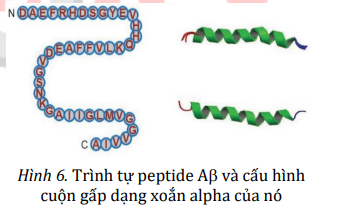
Aβ có thể hòa tan và chứa các vùng ngắn có phiến và xoắn polyproline, tuy vậy chúng vẫn được cấu thành phần lớn từ các xoắn . Tuy nhiên, ở nồng độ đủ cao, các monomer Aβ còn tập hợp thành nhiều cấu trúc khác nhau, bao gồm các oligomer, protofibrils và sợi amyloid. Đây là các cấu trúc bậc bốn chứa nhiều phiến , gọi là sợi beta chéo (cross-beta filament). Các sợi amyloid lớn hơn thường không hòa tan, và chúng có thể tiếp tục tập hợp thành các mảng amyloid, trong khi các oligomer amyloid có thể hòa tan và lan rộng trong não. Theo giả thuyết mảng amyloid, sự kết tập các monomer Aβ được cho là nguyên nhân dẫn đến các đặc điểm của bệnh Alzheimer. Giả thuyết này được đưa ra khi người ta nhận thấy có sự hình thành mảng Aβ trong não ở các bệnh nhân qua đời vì Alzheimer.
Cân bằng AB
Việc sản xuất Aβ thường được cân bằng bởi một số quá trình, bao gồm phân hủy protein, thanh thải qua trung gian tế bào (bản thân nó có thể liên quan đến sự phân hủy protein), vận chuyển tích cực ra khỏi não và lắng đọng thành các tập hợp không hòa tan.
Aβ được tạo ra trong các mô ngoại vi và hệ thần kinh trung ương, nơi nó có thể kết tụ và tạo thành các sợi không hòa tan. Aβ hòa tan có thể được vận chuyển qua BBB từ máu đến não qua RAGE, và từ não đến máu qua LRP. Aβ cũng có thể liên kết với các protein vận chuyển, ví dụ, apoE, apoJ, α2- macroglobulin (α2M), có thể ảnh hưởng đến sự cô lập Aβ cũng như hình thức tích tụ của nó trong não. Aβ có thể bị phân cắt bởi các protease Neprilysin (Nep), men chuyển endothelin (ECE), enzyme phân hủy insulin (IDE), plasmin và các protease phân hủy Aβ khác (MMP, Cathepsin D), cũng như bởi sự thoái hóa qua trung gian microglia.
Ngày càng có nhiều bằng chứng cho thấy rằng sự suy giảm quá trình phân giải protein là một yếu tố quyết định đặc biệt quan trọng đối với mức Aβ trong não và nói rộng ra là của bệnh lý liên quan đến Aβ.
Aβ trong bệnh alzheimer
Các dạng Aβ và tác động gây độc tế bào của chúng
Những nghiên cứu trước đây cho rằng sợi Aβ là một tác nhân gây độc tế bào thần kinh, gây chết tế bào, mất trí nhớ và các dấu hiệu khác của AD. Tuy nhiên, trong hơn hai thập kỷ gần đây, những nghiên cứu sâu hơn đã chỉ ra rằng thể oligomer của peptide Aβ là nguyên nhân lớn nhất gây hư hại tế bào thần kinh.
Tác động siêu phosphoryl hóa Tau
Tau là một protein có vai trò ổn định hệ thống khung xương tế bào, làm ổn định sợi trục thần kinh. Sự tự kết tập các Aβ làm cho protein Tau trở nên siêu phosphoryl hóa (hyperphosphorylated) do làm thay đổi hoạt động của các kinase/phosphatase dẫn đến sự hình thành các đám rối sợi thần kinh (NTFs), làm rối loại chức năng tế bào thần kinh và sau đó là làm mất chức năng synapse. Cuối cùng là bệnh Alzheimer.
Thay đổi hoạt động các chất vận chuyển qua màng
Sự tự kết tập dẫn đến tạo ra một aldehyde độc hại là 4-hydroxynonenal và dẫn đến peroxy hóa lipid. Có thể làm hỏng chức năng của các bơm ATPase, chất mang glucose và protein vận chuyển glutamate. Ngoài ra, Aβ cũng thúc đẩy khử cực màng synapse, làm tăng dòng calci và gây tổn thương ty thể, gián đoạn hoạt động truyền tin qua synapse.
Sự hình thành các ROS
Sự kết tập của Aβ cũng có thể tạo ra các gốc tự do, gây stress oxy hóa do phản ứng với protein hoặc lipid. Điều này dẫn đến làm mất tính toàn vẹn của màng. Ngoài ra thì stress oxy hóa gây ra bởi sự kết tập Aβ cũng được ghi nhận là gây ra quá trình oxy hóa DNA, dẫn đến tổn thương DNA.
Kích hoạt các đáp ứng miễn dịch
Mức Aβ kết tập tăng liên tục cũng làm thúc đẩy các phản ứng miễn dịch bẩm sinh bằng cách kích hoạt microglia, có thể dẫn đến mất tế bào thần kinh thông qua thực bào trực tiếp. Ngoài ra, sự tập hợp Aβ cũng gây ra các phản ứng viêm và giải phóng các chất trung gian của quá trình viêm, chẳng hạn như eicosanoids, chemokine, cytokine tiền viêm và các yếu tố bổ thể, có thể làm tăng quá trình chết tế bào thần kinh, mất các synap thần kinh, dẫn đến giảm sự thanh thải Aβ và các vụn tế bào thần kinh qua trung gian microglia.
Rối loạn chức năng ty thể
Khi tiền chất của Aβ là APP tích tụ tại màng của ty thể, nó ngăn chặn sự chuyển vị của các chất chuyển hóa bên trong ty thể và chuyển vị các protein, dẫn đến gián đoạn chuỗi vận chuyển điện tử và rối loạn chức năng ty thể. Điều này có thể làm tăng thêm quá trình tạo Aβ và khiến cho tế bào rơi vào vòng xoáy của việc tăng sản xuất Aβ và rối loạn chức năng ti thể.
Tác động của Aβ ở mức cơ quan
Sự lắng đọng của peptit Aβ tạo thành mảng, trong khi sự tập hợp của Tau siêu phosphoryl hóa có thể tạo thành đám rối sợi thần kinh. Mặc dù sự lắng đọng các mảng Aβ cũng được ghi nhận tại những vị trí khác trong cơ thể, tuy nhiên chúng chủ yếu tập trung tại các vùng của não. Những vùng của não có thể ghi nhận thấy sự tập trung của chúng bao gồm hồi hải mã, hạch hạnh nhân, vỏ não nội khứu (entorhinal cortex), não trước. Do đó làm ảnh hưởng tới trí nhớ, học tập và các hành vi cảm xúc.
Các dạng của bệnh Alzheimer
Bệnh Alzheimer có hai loại:
Bệnh Alzheimer khởi phát muộn (LOAD)
Dạng này còn được gọi là AD ngẫu nhiên (sporadic type). Chiếm hầu hết các trường hợp AD ghi nhận được, thường là khởi phát muộn (≥ 65 tuổi) với các nguyên nhân không rõ ràng. Đặc trưng bởi một mô hình yếu tố nguy cơ đan xen giữa các yếu tố di truyền và không di truyền. Mỗi gen yếu tố nguy cơ này đều ảnh hưởng đến một hoặc nhiều cơ chế gây bệnh đã biết: tăng sản xuất và tập hợp Aβ; giảm độ thanh thải và thoái hóa Aβ; tăng viêm; và kháng hoạt động của γ-secretase, và do đó dẫn đến thoái hóa thần kinh ở AD. Trong số các gen nguy cơ này, đối với APOE, các allele ε3 và ε4 đã cho thấy có liên quan đến việc tăng nguy cơ AD. Biết rằng, APOE có vai trò phá hủy các beta amyloid
Bệnh Alzheimer gia đình khởi phát sớm (EOFAD)
Chiếm khoảng 5 – 15% các trường hợp, thường liên quan đến các thể di truyền trội và khởi phát ở độ tuổi sớm hơn. Type gia đình có thể do nhiều đột biến gen gây ra. Trong số đó là đột biến ở gene PSEN1 trên nhiễm sắc thể 14 hoặc PSEN2 trên nhiễm sắc thể 1, mã hóa presenilin 1 hoặc 2 là thành phần của phức hệ protein gamma – secretase. Các đột biến có thể làm thay đổi vị trí cắt của gamma -secretase trên APP. Cả hai dạng đột biến kể trên đều dẫn đến tăng tỷ lệ Aβ42/Aβ40. Một nguyên nhân di truyền khác được biết đến ở AD là trisomy 21 (ở hội chứng Down). Do làm tăng số bản sao của APP, dẫn đến tạo ra nhiều APP hơn.
4. Dịch tễ học
Nói về chứng sa sút trí tuệ nói chung, cứ sau 3 giây thì trên thế giới lại có thêm một người mắc bệnh. Vào năm 2020, có hơn 55 triệu người trên toàn thế giới đang sống chung với chứng sa sút trí tuệ. Con số này gần như sẽ tăng gấp đôi sau 20, đạt 78 triệu người vào năm 2030 và 139 triệu người vào năm 2050. Phần lớn sự gia tăng sẽ là ở các nước đang phát triển. Đã có 60% người bị sa sút trí tuệ sống ở các nước có thu nhập thấp và trung bình, nhưng đến năm 2050, con số này sẽ tăng lên 71%. Tốc độ tăng dân số cao tuổi nhanh nhất đang diễn ra ở Trung Quốc, Ấn Độ và các nước xung quanh khu vực Nam Á và Tây Thái Bình Dương.
Về bệnh Alzheimer nói riêng, đây là nguyên nhân chính gây ra chứng sa sút trí tuệ ở người cao tuổi, và là nguyên nhân gây tử vong đứng hàng thứ 5. Bệnh ảnh hưởng đến khoảng 44 triệu người trên toàn thế giới. Các nghiên cứu dịch tễ học gần đây cho thấy tỷ lệ mắc Alzheimer giảm, điều này có thể được giải thích một phần là nhờ sự phát triển trong công tác phòng ngừa rủi ro.
5. Chẩn đoán và điều trị
5.1. Chẩn đoán bệnh Alzheimer
Cộng hưởng từ (chụp MRI) là một kỹ thuật tạo hình cắt lớp sử dụng sóng điện từ trường và sóng radio. Khi các nguyên tử hydrogen trong cơ thể người dưới tác động của từ trường và sóng radio, hấp thụ và phóng thích năng lượng RF (các mô khác nhau sẽ hấp thụ và phóng thích năng lượng khác nhau). Quá trình phóng thích năng lượng được máy thu nhận, xử lý và chuyển đối thành các tín hiệu hình ảnh.
Hình ảnh cộng hưởng từ MRI có độ tương phản cao, sắc nét và rõ ràng, chi tiết giải phẫu tốt và có khả năng tái tạo 3D mang lại hiệu quả chẩn đoán cho bác sĩ đối với bệnh lý của bệnh nhân.
MRI với ưu thế về nhu mô não và dịch đã trở thành chỉ định thường quy khi nghi ngờ bệnh Alzheimer. Mục đích MRI là để đánh giá teo não lan tỏa của bệnh Alzheimer, đặc biệt phát hiện teo thùy thái dương trong trong chẩn đoán bệnh giai đoạn sớm. Các lát cắt theo mặt phẳng trán đi qua hải mã thường được sử dụng để đánh giá.
Ở Việt Nam, dự án Brain Analytics đã ra đời vào năm 2019. Bằng cách sử dụng trí tuệ nhân tạo (AI), phần mềm có thể đưa ra tỷ lệ xác suất mắc bệnh, rút ngắn thời gian chẩn đoán bệnh Alzheimer từ 1 tiếng chỉ còn khoảng 10 phút.
Dưới đây là một số các tổn thương não có thể gặp ở nhóm bệnh nhân Alzheimer:
Đánh giá teo vỏ não toàn thể qua thang điểm GCA (Global Cortical Atrophy scale hay Pasquier scale, độ 0-3). Đại đa số bệnh nhân Alzheimer có teo vỏ não toàn thể từ mức độ nhẹ đến mức độ nặng (chiếm 93.75%).
Teo hồi thái dương trong
Đánh giá bằng thang điểm MTA (Medial Temporal Lobe Atrophy hay MTA scale, độ 0-4): Phần lớn các bệnh nhân Alzheimer có tổn thương teo hồi thái dương trong với nhiều mức độ, từ mở rộng sừng thái dương và khe rãnh mạch mạc đến mất thể tích hải mã mức độ nặng (chiếm tới 87.5%).
Đánh giá các tổn thương chất trắng qua thang điểm Fazekas (Fazekas scale, độ 0-3): Chỉ có 37.5% bệnh nhân Alzheimer có tổn thương chất trắng bệnh lý.
Teo não vùng đỉnh
Đánh giá qua chỉ số Koedam (Koedam score, độ 0-3): Đa số các trường hợp bệnh nhân Alzheimer có teo não vùng đỉnh, chiếm 81.25%.
Hiện nay, có rất nhiều nghiên cứu đã được thực hiện nhằm phát hiện những biến đổi bất thường trong cấu trúc não của bệnh nhân Alzheimer với mục đích nâng cao khả năng chẩn đoán bệnh.
5.2. Điều trị Alzheimer
Có thể kết hợp các biện pháp can thiệp vào môi trường và thuốc:
- Các biện pháp can thiệp vào môi trường
Bệnh nhân sa sút trí tuệ nhẹ đến trung bình thường hoạt động tốt nhất trong môi trường quen thuộc. Cho dù ở nhà hay tại viện dưỡng lão, môi trường nên được thiết kế để giúp duy trì cảm giác tự chủ và phẩm giá cá nhân thông qua việc cung cấp những điều sau:
+ Tăng cường thường xuyên khả năng định hướng
+ Một môi trường đủ ánh sáng, vui vẻ, quen thuộc
+ Giảm tối đa kích thích mới
+ Các hoạt động thường xuyên, ít căng thẳng
- Thuốc
Thuốc điều trị AD hiện tại chỉ có tác dụng điều trị triệu chứng và mang lại lợi ích khiêm tốn. Vì vậy, việc phát triển các loại thuốc khác đã được ưu tiên. Các liệu pháp nhắm vào amyloid β đã là chủ đề nghiên cứu trong gần 30 năm. Tuy nhiên, các loại thuốc có triển vọng cao gần đây không cho thấy lợi ích lâm sàng trong các thử nghiệm pha III. Do đó, các nhà nghiên cứu đang nỗ lực chuyển sang các liệu pháp nhắm vào protein Tau, vì Tau dường như có mối tương quan tốt hơn với mức độ nghiêm trọng của suy giảm nhận thức so với amyloid β.
Hiện tại, hầu hết các chất chống Tau trong các thử nghiệm lâm sàng là liệu pháp miễn dịch và chúng đang ở giai đoạn đầu của nghiên cứu lâm sàng. Cho đến nay, bốn kháng thể đơn dòng chống Tau ( GosuranemAβ, TilavonemAβ, SemorinemAβ và ZagotenemAβ) và một vắc-xin chống Tau (AADvac1) đã đạt đến giai đoạn II.
2 loại thuốc chính được sử dụng trong điều trị Alzheimer:
Cải thiện một cách khiêm tốn chức năng nhận thức và trí nhớ ở một số bệnh nhân. Hiện có bốn loại; nhìn chung, Donepezil, Rivastigmine, và Galantamine đều có hiệu quả tương đương, nhưng Tacrine hầu như không được dùng vì độc tính trên gan của nó. Donepezil là một loại thuốc hàng đầu vì nó có liều dùng một lần/ ngày và được dung nạp tốt. Tác dụng phụ thường gặp nhất là tác dụng trên đường tiêu hóa (ví dụ như buồn nôn, tiêu chảy). Hiếm khi, chóng mặt và loạn nhịp tim xảy ra. Tác dụng phụ có thể được giảm thiểu bằng cách tăng dần liều.
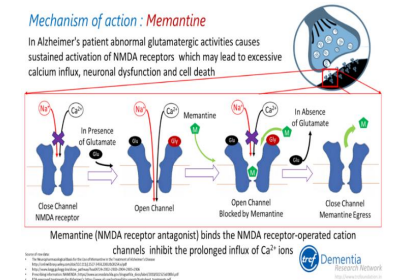
Một một thuốc đối kháng thụ thể N-methyl aspartate, dường như cải thiện được nhận thức và khả năng hoạt động chức năng của bệnh nhân mắc bệnh Alzheimer từ vừa đến nặng. Đối với bệnh nhân suy thận, nên giảm liều hoặc tránh dùng thuốc. Memantine có thể được sử dụng cùng với chất ức chế cholinesterase.
6. Phòng ngừa
Hiện tại, vaccine ngăn ngừa bệnh Alzheimer chỉ mới đang trong giai đoạn khởi đầu thử nghiệm lâm sàng quy mô nhỏ. Tuy nhiên, có một số bước mà chúng ta có thể thực hiện ngay bây giờ có thể làm giảm nguy cơ mắc bệnh.
+ Có một chế độ ăn lành mạnh: Một số bằng chứng cho thấy chế độ ăn Địa Trung Hải có thể làm giảm nguy cơ phát triển bệnh Alzheimer. Chế độ ăn kiêng này bao gồm ít thịt đỏ và nhấn mạnh: các loại ngũ cốc; hoa quả và rau; cá; quả hạch; dầu ô liu; chất béo tốt khác.
+ Tập thể dục: theo như kết quả nghiên cứu của các nhà khoa học thuộc Đại học Washington ở St.Louis (WUSTL), việc tập thể dục điều độ như khuyến cáo của Hiệp hội Tim mạch Mỹ (AHA) sẽ giảm lượng amyloid và protein Tau trong não.
+ Ngưng thuốc lá: hút thuốc lá làm tăng nguy cơ mắc các bệnh về mạch máu, bao gồm đột quỵ hoặc chảy máu não nhỏ hơn. Đây cũng là những yếu tố nguy cơ dẫn đến chứng sa sút trí tuệ. Ngoài ra, các chất độc trong khói thuốc lá làm tăng căng thẳng oxy hóa và viêm nhiễm, cả hai đều có liên quan đến sự phát triển của bệnh Alzheimer
+ Giảm nồng độ Homocysteine: Homocysteine là một loại amino acid có khả năng gây ra hiện tượng vón cục protein. Các nghiên cứu gần đây đã chỉ ra rằng hàm lượng cao homocysteine là yếu tố nguy cơ của bệnh Alzheimer. Tăng cường sử dụng thực phẩm giàu folate (axit folic) và các vitamin B khác (chẳng hạn như B6 và B12) đã được chứng minh là làm giảm mức homocysteine trong cơ thể.
Xem thêm:
Alzheimer: Nguyên nhân, triệu chứng, chẩn đoán và điều trị | Vinmec
Nhận diện bệnh Alzheimer | Vinmec
Bệnh Alzheimer được chẩn đoán thế nào? | Vinmec
Tài liệu tham khảo:
[1]. Bệnh Alzheimer – Rối loạn thần kinh – Cẩm nang MSD – Phiên bản dành cho chuyên gia (msdmanuals.com)
[2]. What Are the Signs of Alzheimer’s Disease? | National Institute on Aging (nih.gov)
[3]. Epidemiology of Alzheimer’s disease and other… | F1000Research
[4]. Dementia statistics | Alzheimer’s Disease International (ADI) (alzint.org)
[5]. 2019 Alzheimer’s disease facts and figures | Elsevier Enhanced Reader
[6]. Evidence-based prevention of Alzheimer’s disease: systematic review and meta-analysis of 243 observational prospective studies and 153 randomized controlled trials – PubMed (nih.gov)
[7]. Alzheimer’s disease: Recent treatment strategies – PubMed (nih.gov)
[8]. http://www.trcfoundation.in
[9]. pubmed.ncbi.nlm.nih.gov/3287712 4/
[10]. Mô tả đặc điểm hình ảnh cộng hưởng từ và hình ảnh 18 F-FDG PET/CT não ở các bệnh nhân mắc bệnh Alzheimer tại Bệnh viện Lão khoa Trung ương | Hội Điện Quang và Y Học Hạt Nhân (radiology.com.vn)
[11]. Cập nhật chẩn đoán và điều trị bệnh Alzheimer (hoithankinhhocvietnam.com.vn)
[12]. Magnetic resonance imaging in Alzheimer’s disease and mild cognitive impairment (nih.gov)
Leave a Reply