Thoái hóa khớp gối là một vấn đề thường gặp ở người lớn tuổi và có thể gây ra nhiều khó khăn trong việc di chuyển và sinh hoạt hàng ngày. Các phương pháp điều trị thoái hóa khớp gối bao gồm cả phương pháp không phẫu thuật và phẫu thuật. Điều trị thoái hóa khớp gối không phẫu thuật là một phương pháp hiệu quả để giảm đau và tăng tính linh hoạt của khớp gối. Bài báo này sẽ tổng hợp các phương pháp điều trị thoái hóa khớp gối không phẫu thuật để giúp đọc giả hiểu rõ hơn về vấn đề này.
Nhóm tác giả: PGS.TS. Trần Trung Dũng, BS. Nguyễn Huy Phương
1. Biện pháp không dùng thuốc
- Luyện tập và giảm cân
Tập luyện giúp giảm cân và làm tăng sức căng của cơ. Cứ mồi Pound (450gam) trọng lượng cơ thể, khi hoạt động sẽ tạo ra một lực tác động lên khớp gối tương đương 6 pound (gấp 6 lần). Do vậy những người nặng cân có nguy cơ thoái hóa khớp gối sớm hơn những người nhẹ cân [20].
Sức mạnh của cơ có vai trò quan trọng trong trận chiến chống lại bệnh thoái hóa khớp gối. Cơ quanh khớp gối có vai trò hấp thụ các lực tác động lên khớp khi gối hoạt động hằng ngày cũng như lúc chơi thể thao. Cơ càng khỏe thì khả năng hấp thụ lực tác động lên khớp gối càng tốt, càng giảm được triệu chứng của thoái hóa khớp gối trên lâm sàng. Vì vậy tập luyện nhằm mục đích làm tăng sức căng, độ khỏe của các cơ như cơ tứ đầu, cơ Hamstring, cơ tam đầu cẳng chân có vai trò quan trọng trong liệu trình điều trị.
- Đeo nẹp gối (Brace)
Nẹp gối thường được sử dụng trong trường hợp thoái hóa gối một khoang (thường gặp khoang trong), dần đến chân vẹo trong hoặc có XII thể vẹo trong (nếu thoái hóa khoang trong), hoặc chân vẹo ngoài hoặc có xu thế vẹo ngoài (nếu thoái hỏa khoang ngoài). Khi đeo nẹp, lực tì lên gối, đặc biệt trên khoang thoái hóa sẽ được hạn chế, nhờ đó bệnh nhân sè giám được triệu chứng đau, cải thiện chức năng gối, điều chỉnh được dáng đi (Hình 2.2).
- Vật lý trị liệu
Vật lý trị liệu cũng góp phần giảm đau, chữa tư thế xấu, duy trì dinh dưỡng cơ ở cạnh khớp, kết hợp làm tăng sức mạnh của cơ.
Các phương pháp nhiệt có tác dụng giảm đau chống co cứng cơ, giãn mạch, tăng cường chuyển hóa dinh dưỡng như: tia hồng ngoại, chườm ngải cứu, đắp Paraphin, tắm ngâm suối bùn nóng…
Các phương pháp điện trị liệu như sóng ngán có tác dụng tạo nhiệt nóng ở trong sâu, tăng cường chuyển hóa, chống phù nề, chống viêm giảm đau. Dòng xung điện có tác dụng kích thích thần kinh cơ, giảm đau, tăng cường chuyển hóa. Dòng Gavanic và Faradic làm tăng cường quá trình khử cực và dẫn truyền thần kinh đưa thuốc giảm đau vào vùng tổn thương.
Laser làm mềm, giảm đau, chống viêm, tái tạo tổ chức.
Siêu âm làm mềm tổ chức tổn thương xơ sẹo trong sâu, chống viêm, giảm đau, tăng cường chuyển hóa, tăng tái tạo tổ chức.
Ngoài ra, thay đổi nghề nghiệp của bệnh nhân nếu có thể, như lựa chọn nghề ít đi lại, hạn chế đứng…để thích nghi với tình trạng bệnh[21].
2. Điều trị bằng thuốc
- Thuốc chống viêm, giảm đau không steroids (NSAIDs)
Đồng thời với việc tập luyện, giảm cân, thuốc chống viêm giảm đau giúp bệnh nhân giảm được triệu chứng.
Các thuốc thuộc dòng giảm đau chống viêm không Steroid (NSAIDs) thường được dùng như Aspirin, Ibuprofen (Advil), Naprosyn (Aleve). Các thuốc có tác dụng mạnh hơn có Indocin, Daypro, Relaten, Celebrex, Lodine và Mobic. Tuy nhiên, những tác dụng phụ của dòng NSAIDs hay gặp là kích ứng và có thể gây loét, chảy máu dạ dày. Tác dụng phụ này tăng cao hơn ở những bệnh nhân trào ngược dạ dày, bệnh nhân đang dùng corticoid, bệnh nhân hút thuốc lá, nghiện rượu. Ngoài ra thuốc còn có thể gây tổn thương cầu thận (đặc biệt ờ những người trên 65 tuổi, người tăng huyết áp, suy tim xung huyết hay bệnh nhân đang dùng thuốc lợi niệu). Do vậy việc dùng thuốc cần cân nhắc đến hiệu quả giảm đau và những tác dụng ngoài mong muốn của thuốc[22].
- Thực phẩm chức năng (‘Nutritional supplements)
Các thực phẩm chức năng chứa các hoạt chất như glucosamine sulfate, chondroitin sulfate thường được dùng bổ trợ trong phác đồ điều trị thoái hóa khớp. Glucosamine là một amino monosaccharide-tiền chất cấu tạo nên mô liên kết, trong đó có mô sụn của khớp, uống glucosamine hằng ngày được cho là sẽ có tác dụng hỗ trợ lên khớp do làm tăng sức bền của mô sụn. Chondroitin sulfate được tìm thấy trong proteoglycans, cũng là một trong những thành phần tạo nên chất căn bản của mô sụn, ảnh hưởng đến sự bền vững của sụn khớp. Chondroitin thường được chiết xuất từ sụn của bò, bê hoặc một số loài cá (cá mập). Tuy vậy, hiệu quả làm vũng bền sụn khớp của glucosamine và chondroitin cho đến nay vẫn đang còn nhiều tranh luận[23].
- Tiêm chất nhờn vào khớp ( Viscosupplementatìon)
Trong khớp luôn có một lượng dịch khớp do màng hoạt dịch tiết ra, có độ nhớt cao giúp giảm độ ma sát giữa các diện khớp khi gối vận động. Độ nhớt của dịch khớp do các phân tử Hyaluronic Acid (HA) tạo nên. Ở người bình thường, trong dịch khớp gối cỏ khoáng 4-5 triệu phân tử HA, các phân tử này kết nối và cuộn lại với nhau tạo nên độ dẻo, sệt và nhớt. HA còn có vai trò tạo liên kết chặt chẽ giữa các chuỗi proteoglycans, cùng với collagen type II, tạo nên cấu trúc bền vững của sụn khớp. Đối với bệnh nhân thoái hóa khớp, số lượng phân từ HA giảm đi rõ rệt, làm cho cấu trúc sụn kém bền vững, dịch khớp giảm độ nhớt, dẫn đến tăng ma sát giữa các diện khớp khi vận động, sụn khớp nhanh bị bào mòn, bong, vỡ [24],
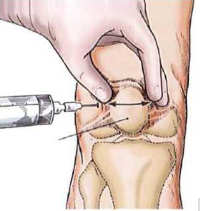
- Tiêm corticoid vào khớp
Tiêm corticoid vào khớp giúp bệnh nhân nhanh chóng giảm được triệu chứng do tác dụng giảm viêm mạnh của corticoid. Tuy nhiên theo các nghiên cứu trên lâm sàng, corticoid làm phá hủy sụn khớp rất nhanh. Tiêm corticoid chỉ có tác dụng giảm triệu chứng đối với những THKG kèm viêm bao hoạt dịch[l],[36]. Ngoài ra, viêm mủ khớp gối sau tiêm là một biến chửng tồi tệ hay gặp nếu quy trình tiêm không đảm bảo vô khuẩn. Chính vì vậy, việc tiêm corticoid vào khớp gối để điều trị thoái hóa khớp được khuyến cáo hết sức hạn chế và thận trọng, chỉ tiêm trong điều kiện vô khuẩn, tiêm tối đa ba mũi.
- Thuốc ức chế Interleukin- 1(11 -ỉ)
Interleukin 1 thúc đẩy quá trình hình thành các men metalloproteinases, aggrecanases. Các men này là tác nhân gây phá hủy, và làm mất tính bền vững của sụn khớp, dẫn đến bệnh cảnh của THKG nguyên phát. Thuốc có tác dụng ức chế sản xuất và hoạt hóa IL-1 [25].
- Huyết tương giàu tiểu cầu (Plate rich plasma-PRP)
Huyết tương giàu tiểu cầu (PRP) tự thân là huyết tương có nồng độ tiểu cầu cao gấp nhiều lần so với huyết tương trong máu bình thường, được tách chiết lừ máu của chính bệnh nhân. Khi tiểu cầu được hoạt hóa sẽ dẫn đến quá trình ly giải các hạt a chứa bên trong tiếu cẩu, từ đó giải phóng ra nhiều loại protein là các cytokine chống viêm và hàng chục các yếu tố tăng trưởng (growth factors) có vai trò quan trọng đối với quá trình làm lành vết thương [26]. Các protein trên sẽ gán vào các thụ thể (receptor) của các tế bào đích tương ứng như tế bào nguồn gốc trung mô, nguyên bào xương, nguyên bào sụn… Sự gắn kết này sẽ hoạt hóa một loại protein dẫn truyền tín hiệu nội bào để truyền thông tin tới gen đặc hiệu tương ứng, kết quả là tạo nên sự tăng sinh tế bào, hình thành chất căn bản, các sản phẩm dạng sụn, thúc đẩy tổng hợp collagen… tham gia vào quá trình sửa chữa, tái tạo tổ chức tổn thương sụn, xương, phần mềm…[27], Trong chuyên ngành cơ xương khớp, liệu pháp PRP tự thân được sử dụng để điều trị bệnh thoái hóa khớp gối, chấn thương thể thao, viêm gân và các điểm bám tận, kích thích sự lành vết thương phần mềm cũng như làm nhanh liền xương sau phẫu thuật.
TÀI LIỆU THAM KHẢO
- Trần Ngọc Ân (1995). Hư khớp và hư cột sống, bệnh thấp khớp. NXB Y học: tr.
I93-209
- Mankin, H.B.J. (1974). The reaction of articular cartilage to injury and osteoarthritis Part II. New England Journal of Medicine; 291, 1335—40.
- David J. Samson, M.S. Mark D. (2007), Treatment of Primary and Secondary Osteoarthritis of the Knee. Evidence Report/Technology Assessment, Number 157.
- Felson DT, Lawrence RC, Dieppe PA, et al (2000). Osteoarthritis: new insights. Part 1: the disease and its risk factors. Ann Intern Med. Ỉ33(8):635“46
- Creamer p, Lethbridge Cejku M. Factors associated with functional impairment in symptomatic knee osteoarthritis. Rheumatology, 39(5), 490-496
- Coventry, M.B. (1965). Osteotomy of the upper portion of the tibia for degenerative arthritis of the knee: a preliminary report. Journal of Bone and Joint Surgery, American Volume, 47A, 984-90.p. 1124.
- Linda J Sandell, Thomas Aigner. (2001). Articular cartilage and changes in arthritis An introduction: Cell biology of osteoarthritis. Arthritis Res, 3:107 -113.
- Horton W.E, Bennion Jr. p, Yang L (2006). Cellular, molecular, and matrix changes in cartilage during aging and osteoarthritis. J Musculoskelet Neuronal Interact; 6(4):379-381.
- Radrigo Campos (2011). Assessment of reproducibility of the Outerbridge and FSA classifications for chondral lesions of the knee. Rev Bras Ortop 46(3):266-69.
- Mainil-Varletl T, Aigner A, Brittberg M, (2002). The International Cartilage Repair Society (ICRS) ‘Histological Visual Scale. European Cells and Materials; 4(1), 10.
- Hart D. J, Spector T. D (2003). Kellgren & Lawrence grade 1 osteophytes in the knee—doubtful or definite?. Osteoarthritis and Cartilage; 11, 149-150.
- KellgrenJ. H, Lawrence J. S(1957). Radiologic assessment of osteoarthritis, Ann. Rheum Dis\ vol. 16, pp. 494-501.
- Bruno c, Vande Berg (2002). Assessment of Knee Cartilage in Cadavers with Dual-Detector Spiral CT Arthrography and MR Imaging. Radiology, 222(2): tr. 430-435.
- Colton CL (1988). Magnetic Imaging of the knee. (Book review). J Bone Joint Surg;10-B\ 859.
- Recht MP, Resnick D (1994). MR imaging of articular cartilage: current status and future directions. AJR; 163: 283-290
- Dương Đình Toàn, Nguyễn Xuân Thùy (2014), “Điều trị thoái hóa khớp gối bằng phẫu thuật nội soi”, Phẫu thuật nội soi khớp gối, NX lì Y học, tr. 212-227,
- Livesley, P.J., Doherty, M., Needoff, M., and Moulton, A. (1991). Arthroscopic lavage of osteoarthritic knees. Journal of Bone and Joint Surgery, British Volume; 73B, 922-6.
- Dieuwke Schiphof, Mark de Niet (2011). Identifying Knee Osteoarthritis. The Netherlands Organization for Scientific Research, ISBN: 978-94-6169-194.
- Belo J. N, Berger M. Y.(2009). The prognostic value of the clinical ACR classification criteria of knee osteoarthritis for persisting knee complaints and increase of disability in general practice. Osteoarthritis Research Society International; 17, 1288-1292.
- Brett Levine, MD. Treatment Options for Osteoarthritis of the Knee. Clinician s Guide, AHRQ Pub. No. 09-EHC010-3.
- Robert T. Bashaw, PT (2005). Rehabilitation of the Osteoarthritic Patient: Focus on the Knee. Clin Sports Med; 24, 101 – 131.
- Choosing Pain Medicine for Osteoarthritis: A Guide for Consumers Agency for Healthcare Research and Quality, January 2007
- Yuanyuan Wang, Louise F (2004). The Effect of Nutritional Supplements on Osteoarthritis. Alternative Medicine Review; 9 (3), 275-291.
- Viscosupplementation for Osteoarthritis of the Knee, Rapid Review: Public March 17,2010
- Agency for Healthcare Research and Quality. Three treatments for osteoarthritis of the knee: Evidence shows lack of benefit. April 2009.
- Burnouf, T., Goubran, H. A.et al (2013). Blood-derived biomaterials and platelet growth factors ill regenerative medicine. Blood Reviews; 27 (2), 77-89.
- Tinsley, B. A., Ferreira, J. v.et al (2012). Platelet-Rich Plasma Nonoperative Injection Therapy-A Review of Indications and Evidence. Operative Techniques in Sports Medicine; 20 (2), 192-200.
- John C. Richmond (2008). Surgery for Osteoarthritis of the Knee. MDRheum Dis Clin N A; 34, 815-82
- Gupta S, Hawker GA, Laporte A (2005). The economic burden of disabling hip and knee osteoarthritis (OA) from the perspective of individuals living with this condition. Rheumatology, 44:153 i -1537.
- Chang, R.W, Falconer, J., Stulberg, S.D (1993). A randomised controlled trial of arthroscopic surgery versus closed needle joint lavage for patients with osteoarthrosis of the knee. Arthritis and Rheumatism, 36, 289-96.
- Dandy, D.J. (1991). Arthroscopic debridement of the knee for osteoarthritis (Editorial). Journal of Bone and Joint Surgery, British Volume, 73 B, 877-8.
- Dawes, P.T., Kirlew, C., and Haslock, I. (1987). Saline washout for knee osteoarthritis: results of a controlled study5C//m«j/ Rheumatology’, 6, 61-3.
- Moseley JB et al. (2002) A controlled trial of arthroscopic surgery for osteoarthritis of the knee. N Engl J Med 347: 81-88.
- Livesley, P.J., Doherty, M., Needoff, M., and Moulton, A. (1991). Arthroscopic lavage of osteoarthritic knees. Journal of Bone and Joint Surgery, British Volume; 73B, 922-6.
- Steinwachsl MR, Guggi Th (2008). Marrow stimulation techniques. Injury, Int. J. Care Injured; 39S1, S26 S31
- Peter F. Sharkey, MD (2010). Subchondral Bone Marrow Lesions Associated With Knee Osteoarthritis. A Case Report & Literature Review. Am J Orthop; 41 (9):413-417,
- Milhofer K, Williams RJ 3rd, Warren RF, et al (2005). The microfracture technique for the treatment of articular cartilage lesions in the knee. A prospective cohort study. J Bone Joint SurgAm; 87:1911 -20.
- Steadman JR, Kocher MS (2003). Outcomes of microfracture for traumatic chondral defects of the knee: average 11-year follow-up. Arthroscopy; 19:477-84.
- Steadman JR, Rodkey WG, Rodrigo JJ (2001). Microfracture: surgical technique and rehabilitation to treat chondral defects. Clin Orthop Relat Res; (391 Stihl):S362-9.
- Christian Ossendorfl, Matthias R Steinwachs (2011). Autologous chondrocyte implantation (AC1) for the treatment of large and complex cartilage lesions of the knee. Arthroscopy, Rehabilitation, Therapy & Technology>; 3:11
- Zeifang F, Oberle D, Nierhoff C, et al (2010). Autologous chondrocyte implantation using the original periostcura-cover technique versus matrix- associated autologous chondrocyte implantation: a randomized clinical trial. Am J Sports Med; 38(5):924-33
- Peterson L, Brittberg M (2002). Autologous chondrocyte implantation: biomechanics and long-term durability. Am J Sports Med; 30:2-12
- Bugbee WD, Convert FR (1999). Osteochondral allograft transplantation. Clin Sports Med; 18:67-75.
- Aubin PP, Cheah HK, Davis AM, et al (2001). Long-term follow-up of fresh femoral osteochondral allografts for posttraumatic knee defects. Clin Orthop Relat Res; (391 Suppl): S318-27.
- Beaver RJ, Mahomed M, Backstein D, et al (1992). Fresh osteochondral allografts for post-traumatic defects in the knee. A survivorship analysis.,/ Bone Joint Surg Br; 74:105-110.
- Pittenger MF et al. (1999). Multilineage potential of adult human mesenchymal stem cells. Science 284; J43-147.
- Kolf CM et al. (2007) Mesenchymal stromal cells. Biology of adult mesenchymal stem cells: regulation of niche, self-renewal and differentiation. Arthritis Res Ther 9: 204.
- Coventry, M.B. (1965). Osteotomy of the upper portion of the tibia for degenerative arthritis of the knee: a preliminary report. Journal of Bone and Joint Surgery, American Volume, 47A, 984-90.P. 1124
- Coventry, M.B. (1987). Proximal tibial varus osteotomy for osteoarthritis of the lateral compartment of the knee. Journal of Bone and Joint Surgery, American Volume, 69A, 32-8.
- Gariepy, R. (1964). Genu valgum treated by high tibia! osteotomy. Journal of Bone and Joint Surgery, British Volume, 46B, 783—4.
- Insall, J.N. (1996). Knee arthroplasty, then, now and tomorrow. In Current concepts in primary and revision total knee arthroplasty (ed. J.N. Insall, W.N. Scott, and G.R. Scuderi), pp. 1 -2. Lippincott-Raven, Philadelphia, PA
Leave a Reply