Ung thư biểu mô tế bào gan (UTBMTBG) là loại tổn thương thường gặp nhất trong các loại ung thư tại gan, nằm trong sáu loại ung thư phổ biến nhất trên thế giới và nằm trong ba loại ung thư phổ biến nhất tại Việt Nam. UTBMTBG đứng đầu trong các nguyên nhân tử vong liên quan đến ung thư tại Việt Nam. Điều trị ung thư biểu mô tế bào gan có nhiều phương pháp cho từng trường hợp cụ thể.
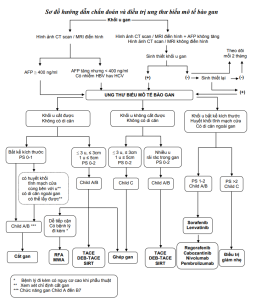
1. ĐIỀU TRỊ UTBMTBG
1.1. Nguyên tắc điều trị UTBMTBG
– Điều trị (các) khối ung thư biểu mô tế bào gan ở giai đoạn còn khả năng điều trị.
– Điều trị bệnh lý nền tảng hay yếu tố nguy cơ (viêm gan siêu vi B hoặc C, xơ gan…).
– Điều trị nội khoa kết hợp chăm sóc giảm nhẹ ở giai đoạn muộn.
1.2. Các phương pháp điều trị đối với tổn thương ung thư biểu mô tế bào gan
1.2.1. Phẫu thuật cắt bỏ phần gan có mang khối u (phẫu thuật cắt gan)
Phẫu thuật cắt gan được coi là điều trị triệt để đối với ung thư biểu mô tế bào gan và an toàn ngay cả đối với các bệnh nhân có xơ gan.
Tại Việt Nam, phẫu thuật cắt gan nên được thực hiện đối với các trường hợp:
– Phần gan có khối u dự kiến cắt bỏ được (theo giải phẫu hay không theo giải phẫu).
– Thể tích gan dự kiến còn lại phù hợp với bệnh nhân. Nên đo thể tích gan để góp phần ra chỉ định cắt gan đối với các trường hợp dự kiến cắt ≥ 50% thể tích gan.
– Chức năng gan là Child-Pugh A đến B7. Có thể đánh giá chức năng gan dựa trên xét nghiệm thanh lọc Indocyanin green (ICG test) để quyết định mức độ cắt gan.
– Điểm hoạt động cơ thể (Performance Status – PS) 0-2, không có di căn xa.
Nên xem xét phẫu thuật cắt gan cho các trường hợp có huyết khối tĩnh mạch cửa cùng bên với phần gan định cắt, cũng như các trường hợp có tổn thương di căn ngoài gan (hạch cuống gan, tuyến thượng thận, di căn tại mạc nối lớn, …) có thể lấy bỏ được khi phẫu thuật cắt gan.
1.2.2. Phẫu thuật ghép gan
Phẫu thuật ghép gan là biện pháp duy nhất có thể giúp bệnh nhân điều trị cả UTBMTBG lẫn bệnh lý gan nền. Chỉ định ghép gan cho bệnh nhân UTBMTBG tùy thuộc vào nhiều yếu tố, trong đó có cân nhắc tới hiệu quả của phẫu thuật cắt gan và các phương pháp điều trị tại chỗ – tại vùng, cũng như mức độ ưu tiên so với nhu cầu ghép gan của các bệnh nhân không phải là UTBMTBG.
Các hướng dẫn điều trị trên thế giới đều khuyến cáo xem Tiêu chuẩn Milan (chỉ có 01 u với kích thước khối u không quá 5cm, hay không quá 03 u với kích thước mỗi u không quá 3cm) là tiêu chuẩn vàng để ghép gan cho UTBMTBG, và ghép gan là lựa chọn hàng đầu cho các trường hợp UTBMTBG nằm trong Tiêu chuẩn Milan nhưng không phù hợp để phẫu thuật cắt gan, đặc biệt là khi có xơ gan mất bù. Các cơ sở y tế có thể cân nhắc vận dụng các tiêu chuẩn mở rộng hơn khi chỉ định ghép gan nhưng cần có hội chẩn cụ thể.
Có thể cân nhắc các biện pháp điều trị bắc cầu để làm giảm giai đoạn UTBMTBG trước khi xem xét ghép gan.
1.2.3. Phá hủy khối u tại chỗ (đốt u)
Phá hủy khối u tại chỗ (đốt u) có thể thực hiện bằng sóng cao tần (Radiofrequency Ablation-RFA), bằng vi sóng (Microwave Ablation-MWA), bằng cách tiêm cồn vào khối u (Percutaneous Ethanol Injection-PEI) hay bằng đốt lạnh (cryoablation) trên bệnh nhân có PS 0-2, chức năng gan là Child Pugh A,B, không có di căn xa.
Phá hủy khối u tại chỗ (đốt u) nên thực hiện cho các trường hợp UTBMTBG có số lượng u ≤ 3 với kích thước u ≤ 3cm, hoặc có 1 u với kích thước u ≤ 5cm, nhất là khi các trường hợp này không phù hợp để phẫu thuật cắt gan (do vị trí u, do tình trạng bệnh nhân). Phá hủy khối u tại chỗ (đốt u) cũng được coi là biện pháp thay thế cho phẫu thuật cắt gan trong trường hợp u có kích thước nhỏ ≤ 3cm.
Phá hủy khối u tại chỗ (đốt u) nên thực hiện cho các khối u dễ tiếp cận dưới hướng dẫn của hình ảnh học (siêu âm, CT scan, MRI). Những trường hợp chỉ định phá hủy khối u kích thước > 5cm cần được hội chẩn.
Tiêm cồn vào khối u chỉ nên thực hiện khi các biện pháp phá hủy khối u (đốt u) khác không thực hiện được vì lý do kỹ thuật, và nếu sử dụng thì chủ yếu là cho u ≤ 2cm.
Đối với (các) khối u chưa loại trừ được là UTBMTBG, có thể phối hợp sinh thiết và phá hủy u tại chỗ trong cùng một lần nằm viện.
1.2.4. Cắt nguồn máu nuôi khối u phối hợp với diệt tế bào ung thư bằng hóa chất
Có các hình thức như:
– Nút mạch hóa chất thường quy (conventional TransArterial Chemo-Embolization – cTACE)
– Nút mạch sử dụng hạt nhúng hóa chất (Drug-eluting bead TACE – DEB-TACE)
TACE được chỉ định cho các trường hợp UTBMTBG mà khối u không cắt được, hoặc có nhiều u ở cả hai thùy, chưa có xâm nhập mạch máu và chưa có di căn ngoài gan, trên bệnh nhân có PS 0-2, chức năng gan là Child Pugh A,B. TACE nên được thực hiện chọn lọc hay siêu chọn lọc để tăng hiệu quả, giảm biến chứng và giảm ảnh hưởng đến phần gan lành quanh u.
TACE chọn lọc cũng được chỉ định cho các trường hợp u nhỏ nhưng không thể thực hiện đốt u được do vị trí khó hay do có các bệnh lý đi kèm làm tăng nguy cơ biến chứng.
Trong một số trường hợp có u đã vỡ hoặc có nguy cơ vỡ mà tình trạng chức năng gan hoặc tình trạng cơ thể không cho phép làm TACE thì có thể làm nút mạch đơn thuần (TransArterial Embolization – TAE) để điều trị tạm thời.
Đánh giá hiệu quả của TACE cần dựa vào hình ảnh học và sự thay đổi của các chỉ dấu sinh học cũng như của chức năng gan sau TACE. Tại Việt Nam, có thể thực hiện TACE nhiều lần nếu (các) khối u còn tiến triển hoặc xuất hiện u mới và tình trạng chức năng gan và tình trạng cơ thể cho phép. Cần hội chẩn để đánh giá TACE thất bại hay không trước khi quyết định ngưng làm TACE tiếp tục để chuyển sang hóa trị toàn thân.
1.2.5. Xạ trị trong chọn lọc (Selective Internal Radiation Therapy – SIRT)
Sử dụng hạt vi cầu phóng xạ Ytrium-90 (90Y) bơm vào động mạch nuôi khối u gan. Các hạt vi cầu này sẽ đi vào các nhánh động mạch nhỏ khắp trong khối u gây tắc mạch.
Khối u sẽ bị tiêu diệt theo hai cơ chế: giảm nuôi dưỡng u và bức xạ bêta năng lượng 0,93MeV được phát ra từ đồng vị phóng xạ 90Y gắn trên các hạt vi cầu sẽ tiêu diệt các tế bào ung thư và làm giảm thể tích hoặc tiêu hoàn toàn khối u gan mà rất ít ảnh hưởng đến tổ chức lành xung quanh.
– Chỉ định:
+ UTBMTBG không còn khả năng phẫu thuật, hoặc có chống chỉ định phẫu thuật hay bệnh nhân từ chối phẫu thuật.
+ Tổng trạng còn tốt ECOG ≤ 1, chức năng gan còn bù (Child-Pugh A, B) + Shunt lưu thông hoạt tính phóng xạ lên phổi < 20% trên xạ hình Tc-99m MAA + Chưa từng xạ trị trước đó vào gan
– Chống chỉ định:
+ Có luồng thông động mạch gan-phổi (shunt gan-phổi) lớn (> 20%) + Xơ gan mất bù, bệnh não gan
+ Thể trạng quá yếu, dự kiến thời gian sống thêm dưới 3 tháng.
1.2.6. Truyền hoá chất qua động mạch gan (Hepatic Arterial Infusion Chemotherapy – HAIC)
Phương pháp sử dụng buồng truyền và dây dẫn đặt chọn lọc vào động mạch gan sau khi đã nút tắc các nhánh mạch của động mạch gan cấp máu cho các tạng khác. Phương pháp này giúp đưa hóa chất khu trú tại gan nên giảm các tác dụng phụ hơn so với hóa trị toàn thân. Hóa chất thường dùng là tổ hợp liều thấp của Cisplatin với 5-Fluorouracil (phác đồ FP liều thấp). Chỉ định chủ yếu cho các trường hợp UTBMTBG giai đoạn tiến xa có xâm lấn tĩnh mạch cửa. Các biến chứng của phương pháp này bao gồm: viêm tắc mạch, loét dạ dày ruột do rò thuốc và nhiễm khuẩn hoặc tắc dây truyền.
1.2.7. Xạ trị
– Xạ trị chiếu ngoài
+ Chỉ định: xạ trị chiếu ngoài bằng máy gia tốc có thể dùng đối với những trường hợp không phẫu thuật được. Lựa chọn trường chiếu xạ phụ thuộc vào vị trí, kích thước khối u. Liều xạ trị tùy thuộc vào thể tích trường chiếu, dao động từ 50- 70Gy, phân liều 2Gy/ngày.
+ Chỉ định xạ trị toàn gan trong những trường hợp điều trị giảm nhẹ triệu chứng, liều xạ 21Gy, phân liều 3Gy/ngày.
+ Ngoài ra, có thể chỉ định xạ trị cho những trường hợp UTBMTBG di căn xương, di căn não, di căn phổi, di căn hạch. Thể tích và liều xạ phụ thuộc vào vị trí và kích thước tổn thương.
+ Mô phỏng bằng CT, MRI hoặc PET/CT, PET/MRI.
+ Kỹ thuật: có thể dùng các kỹ thuật thường quy 3D, hoặc các kỹ thuật xạ trị tiên tiến giúp tăng hiệu quả, độ chính xác và giảm thiểu tác dụng phụ như xạ trị điều biến liều (Intensity Modulated Radiation Therapy – IMRT), xạ trị điều biến thể tích (Volumetric Modulated Arc Therapy – VMAT).
– Xạ phẫu
+ Xạ phẫu có thể bằng dao gamma cổ điển, dao gamma quay (Rotating Gamma Knife), CyberKnife, …
+ Nguyên lý: bức xạ hội tụ với liều rất cao tại tiêu điểm khối u gây hoại tử hoặc bất hoạt tế bào u, đồng thời liều xạ tại các mô lành ở mức tối thiểu, rất ít gây tác dụng phụ cho cơ quan lành xung quanh.
+ Chỉ định cho các trường hợp di căn một vài ổ tại não.
– Xạ phẫu định vị thân (Stereotatic Body Radiation Therapy – SBRT)
+ Xạ phẫu định vị thân là phương pháp đang có nhiều bằng chứng đánh giá tác dụng tích cực, có thể dùng cho các khối u nguyên phát tại gan, không còn khả năng cắt bỏ hay các phương pháp phá huỷ u tại chỗ, và các khối u di căn ở gan.
– Cấy hạt phóng xạ
+ Cấy hạt phóng xạ vào khối u hoặc diện u trong các trường hợp không phẫu thuật triệt căn hoặc không thể phẫu thuật do có bệnh lý kèm theo hay bệnh nhân từ chối phẫu thuật.
+ Các biện pháp xạ trị khác bằng tia hạt (Particle Beam Radiation Therapy) như tia proton hay ion carbon cho các kết quả bước đầu khá khích lệ nhưng vẫn còn cần các nghiên cứu tiếp theo để xác định hiệu quả đối với UTBMTBG.
1.2.8. Điều trị toàn thân
Các trường hợp UTBMTBG tiến triển, không còn chỉ định phẫu thuật, nút mạch, đốt u thì có thể xem xét dùng điều trị toàn thân.
a. Điều trị đích và điều trị miễn dịch ung thư biểu mô tế bào gan
– Sorafenib là thuốc ức chế đa kinase đường uống, ức chế khoảng 40 kinase, bao gồm cả VEGFR-2 (vascular endothelial growth factor receptor 2) và BRAF (B-Raf proto-oncogene, serine/threonine kinase). Sorafenib được coi là điều trị bước một chuẩn cho các trường hợp UTBMTBG không còn đáp ứng hoặc không phù hợp với các biện pháp điều trị can thiệp tại chỗ tại vùng như nút mạch hóa chất, hoặc đã có xâm nhập mạch máu đại thể hay di căn ngoài gan, với điều kiện chức năng gan còn tốt (Child-Pugh A hay B7). Các tác dụng của sorafenib có thể gặp như: phản ứng da bàn tay-bàn chân, tiêu chảy, tăng huyết áp,….Các tác dụng phụ này thường xảy ra sớm và có thể dự phòng và kiểm soát được với các biện pháp dùng thuốc và không dùng thuốc. Liều dùng sorafenib là 400mg, uống 2 lần/ngày cho tới khi bệnh tiến triển. Có thể điều chỉnh liều sorafenib cho phù hợp theo mức độ của độc tính. Nên duy trì việc sử dụng sorafenib cho bệnh nhân ít nhất cho tới khi bệnh tiến triển trên hình ảnh học, hoặc trên lâm sàng, khi đó nên hội chẩn để xem xét chuyển sang điều trị bước hai.
– Lenvatinib là thuốc ức chế đa kinase đường uống, ức chế VEGFR 1-3, FGFR 1-4 (fibroblast growth factor receptor 1-4) và một số kinase khác. Lenvatinib cho kết quả về thời gian sống còn không kém hơn sorafenib và có thời gian sống không bệnh tiến triển, thời gian cho đến khi bệnh tiến triển và tỷ lệ đáp ứng chung ưu thế hơn sorafenib trong các nghiên cứu trên các bệnh nhân UTBMTBG tiến triển, không còn đáp ứng đối với các biện pháp điều trị tại chỗ, tại vùng hoặc đã có di căn ngoài gan, nhưng chưa có huyết khối nhánh chính tĩnh mạch cửa. Lenvatinib được sử dụng điều trị bước một cho các bệnh nhân thuộc nhóm trên. Liều dùng lenvatinib là 12mg/ngày ở bệnh nhân trên 60kg hoặc 8mg/ngày ở bệnh nhân dưới 60kg, uống hàng ngày. Các tác dụng phụ của lenvatinib cũng tương tự sorafenib.
– Regorafenib, một thuốc ức chế đa kinase đường uống, tác động vào các quá trình sinh mạch máu, tăng sinh tế bào u và vi môi trường u với các đích ức chế như VEGFR 1-3, KIT, RET, RAF-1, BRAF, PDGFR, FGFR, CSF1R giúp cải thiện tỉ lệ sống còn ở các bệnh nhân UTBMTBG đã điều trị bằng sorafenib, dung nạp được sorafenib, nhưng bệnh vẫn tiến triển. Các tác dụng phụ của regorafenib cũng tương tự sorafenib. Do đó, regorafenib được chấp thuận như là điều trị bước hai cho UTBMTBG khi đã thất bại với sorafenib. Regorafenib là thuốc có nghiên cứu đánh giá hiệu quả của chuỗi phối hợp sau tiến triển với sorafenib, cho thấy thời gian sống còn là 26 tháng tính từ thời điểm bắt đầu bước 1. Liều dùng regorafenib: 160mg/ngày, uống ngày 1-21, chu kỳ 28 ngày.
– Pembrolizumab là các thuốc ức chế chốt kiểm soát miễn dịch (immune checkpoints inhibitors) cho thấy có thể cải thiện tỉ lệ sống còn ở các bệnh nhân UTBMTBG đã điều trị bằng sorafenib hoặc lenvatinib, và đã được chấp thuận điều trị bước hai cho UTBMTBG khi đã thất bại với sorafenib hoặc lenvatinib. Các tác dụng phụ chủ yếu là mệt mỏi, ngứa và phát ban. Liều dung pembrolizumab: 200mg, truyền tĩnh mạch chu kỳ 3 tuần
– Một số nghiên cứu cho thấy việc kết hợp bevacizumab với atezolizumab cho hiệu quả trong việc cải thiện thời gian sống thêm không bệnh ở các bệnh nhân UTBMTBG giai đoạn muộn hoặc tái phát. Liều dùng:
Atezolizumab : 1200mg truyền tĩnh mạch ngày 1
Bevacizumab : 15mg/kg truyền tĩnh mạch ngày 1, chu kỳ 21 ngày
– Ramucirumab là kháng thể kháng VEGFR có hiệu quả điều trị ung thư gan có AFP ≥ 400 ng/ml.
– Cabozantinib là một thuốc ức chế MET, VEGFR2, AXL và RET, cũng giúp cải thiện tỉ lệ sống còn ở các bệnh nhân UTBMTBG đã điều trị bằng sorafenib.
b. Hóa trị toàn thân: một số phác đồ hóa chất có thể áp dụng trong UTBMTBG nhưng hiệu quả rất hạn chế.
– Phác đồ PIAF : chu kỳ 3 tuần
Doxorubicin : 40mg/m2, truyền tĩnh mạch ngày 1
Cisplatin : 20mg/m2, truyền tĩnh mạch ngày 1, 2, 3, 4
5-FU : 400mg/m2, truyền tĩnh mạch ngày 1, 2, 3, 4 Interferon α-2a : tiêm dưới da 5 MIU/m2, ngày 1, 2, 3, 4
– Phác đồ GEMOX : chu kỳ 2 tuần
Gemcitabine : 1.000mg/m2, truyền tĩnh mạch ngày 1
Oxaliplatin : 100mg/m2, truyền tĩnh mạch ngày 2
– Phác đồ FOLFOX 4 : chu kỳ 2 tuần
Folinic acid : 200mg/m2, truyền tĩnh mạch ngày 1
Oxaliplatin : 85mg/m2, truyền tĩnh mạch ngày 1
5-FU : 400mg/m2, tiêm/truyền tĩnh mạch bolus ngày 1 5-FU : 1.200mg/m2, truyền tĩnh mạch ngày 1, 2
1.3. Phối hợp các phương pháp điều trị
Có thể phối hợp các phương pháp nói trên cho từng trường hợp cụ thể.
1.4. Điều trị giảm nhẹ
Được thực hiện khi
– Tổng thể tích các khối u vượt quá 50% thể tích gan.
– Đã có huyết khối tĩnh mạch cửa, tĩnh mạch gan, tĩnh mạch chủ dưới, …
– Đã có di căn ngoài gan.
– PS > 2, Child Pugh C.
Ở các bệnh nhân có xơ gan, có thể dùng Acetaminophen (Paracetamol) để giảm đau nếu đau nhẹ, và dùng các thuốc giảm đau gây nghiện (opioids) nếu đau từ vừa đến nhiều (lưu ý tránh tác dụng phụ là táo bón). Có thể xạ trị để giảm đau do di căn xương hay để ngăn ngừa gãy xương bệnh lý.
Cần lưu ý đến vấn đề dinh dưỡng và hỗ trợ tâm lý cho các bệnh nhân UTBMTBG giai đoạn muộn.
1.5. Điều trị hỗ trợ
– Điều trị bệnh lý gan nền tảng và nâng đỡ chức năng gan.
– Dùng thuốc kháng virus khi có chỉ định.
– Hỗ trợ dinh dưỡng để nâng tổng trạng.
– Điều trị các bệnh lý đi kèm.
2. THEO DÕI VÀ TÁI KHÁM
– Theo dõi định kỳ cho đến khi bệnh nhân không thể tiếp tục được theo dõi nữa (tử vong, mất liên lạc,…).
– Tùy phương pháp, hiệu quả điều trị, thời gian bệnh ổn định hay tiến triển mà hẹn tái khám mỗi tháng, mỗi hai tháng, hay mỗi ba tháng, cụ thể:
+ Bệnh nhân vừa được điều trị sẽ được hẹn tái khám sau 01 tháng để đánh giá kết quả điều trị. Nếu bệnh tiến triển và còn khả năng điều trị thì chỉ định phương pháp điều trị và cho lịch hẹn. Nếu kết quả điều trị là ổn thì hẹn tái khám sau 02 tháng.
+ Nếu tại lần tái khám sau 02 tháng mà bệnh tiến triển lại và còn khả năng điều trị thì chỉ định phương pháp điều trị và cho lịch hẹn. Nếu bệnh vẫn ổn thì hẹn tái khám sau mỗi 03 tháng.
– Mỗi lần tái khám, bệnh nhân sẽ được đánh giá về lâm sàng và làm đầy đủ các xét nghiệm cận lâm sàng và hình ảnh học như đã nêu trong phần Chẩn đoán. Cần thiết làm các chỉ dấu sinh học AFP, AFP-L3, PIVKA II (DCP) để đánh giá kết quả điều trị, theo dõi diễn tiến bệnh và phát hiện tái phát UTBMTBG.
– Nếu đã xác định bệnh nhân có nhiễm virus viêm gan B hay C thì nên làm đầy đủ các xét nghiệm để chỉ định điều trị (nếu cần) và đánh giá hiệu quả điều trị các virus này, cụ thể là: HBsAg, HbsAb, HbcAb, HBeAg, HBeAb, định lượng HBV-DNA, AntiHCV, định lượng HCV-RNA…
3. PHÒNG BỆNH
– Tiêm vaccine phòng bệnh viêm gan siêu vi B cho những người chưa nhiễm, đặc biệt là cho trẻ sơ sinh.
– Chủ động tầm soát định kỳ UTBMTBG trên những người có nhiễm HBV, HCV, xơ gan.
– Tuyên truyền giáo dục tránh lây nhiễm HBV, HCV qua đường tình dục và từ mẹ sang con, kiểm soát chặt chẽ việc truyền các chế phẩm máu.
– Tuyên truyền hạn chế sử dụng các đồ uống có cồn.
Bệnh viện Đa khoa Quốc tế Vinmec đã đưa hệ thống máy móc, thiết bị hiện đại đạt chuẩn vào công tác thăm khám, chẩn đoán, gây mê và điều trị các bệnh lý liên quan đến gan. Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.
Nguồn: GLOBOCAN. Bộ Y tế, “Hướng dẫn chẩn đoán và điều trị ung thư biểu mô tế bào gan”
Leave a Reply