Tăng áp động mạch phổi (Pulmonary Artery Hypertension) là một căn bệnh hiếm gặp, nhưng có thể gây ra những hậu quả nghiêm trọng cho sức khỏe của con người. Bệnh lý này đặc trưng bởi tăng áp suất trong các động mạch phổi, dẫn đến sự suy giảm chức năng của tim và phổi. Trong bài này sẽ trình bài một cách tổng quan về tăng áp động mạch phổi, từ định nghĩa, phân loại và sinh lý bệnh.
1. Tổng quát về tăng áp động mạch phổi
1.1. Định nghĩa
Theo như định nghĩa trước kia, tăng áp động mạch phổi ( Pulmonary Hypertension – PH) là khi áp lực động mạch phổi trung bình (mean pulmonary artery pressure –mPAP) ≥ 25 mmHg khi nghỉ ngơi.
Hiện nay, theo ESC/ERS 2022 thì tăng áp động mạch phổi được xác định bởi áp lực động mạch phổi trung bình >20 mmHg khi nghỉ ngơi. Định nghĩa về tăng huyết áp động mạch phổi (PAH) cũng bao hàm sức cản mạch máu phổi (PVR) >2 đơn vị Wood và áp lực động mạch phổi bít ≤ 15 mmHg.
1.2. Phân loại
Tổ chức Y tế Thế giới (WHO) và Hiệp hội tim mạch New York (NYHA) phân loại bệnh tăng huyết áp động mạch phổi thành 5 nhóm dựa trên các đặc điểm chung về cơ chế bệnh và gồm các nhóm sau đây
1.2.1. Tăng áp động mạch phổi (Pulmonary Hypertension)
Nhóm này tập trung vào các bệnh ảnh hưởng trực tiếp đến động mạch phổi, dẫn đến các thay đổi cấu trúc, tăng sinh cơ trơn và chức năng bất thường của tế bào nội mạc.
Tăng huyết áp phổi được định nghĩa trong thủ thuật mạch máu tim khi ở trạng thái nghỉ, áp lực động mạch phổi trung bình ≥ 20 mmHg, áp lực động mạch phổi bít ≤ 15 mmHg và kháng trở động mạch phổi ≥ 3 đơn vị Wood.
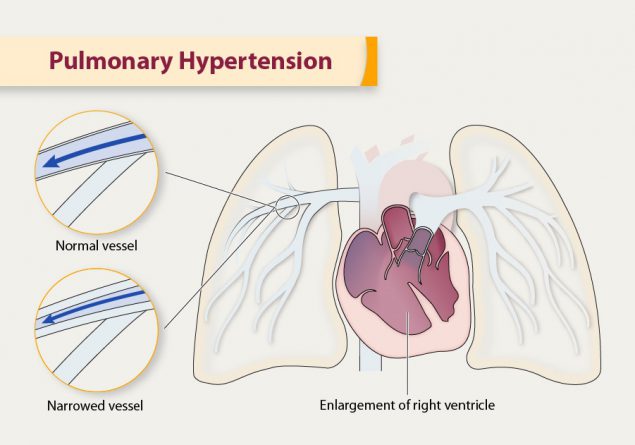
1.2.2. Tăng áp động mạch phổi do bệnh tim Trái (Pulmonary venous hypertension due to left heart disease).
Nhóm này bao gồm chức năng bất thường của thất trái hoặc bệnh lý van tim.
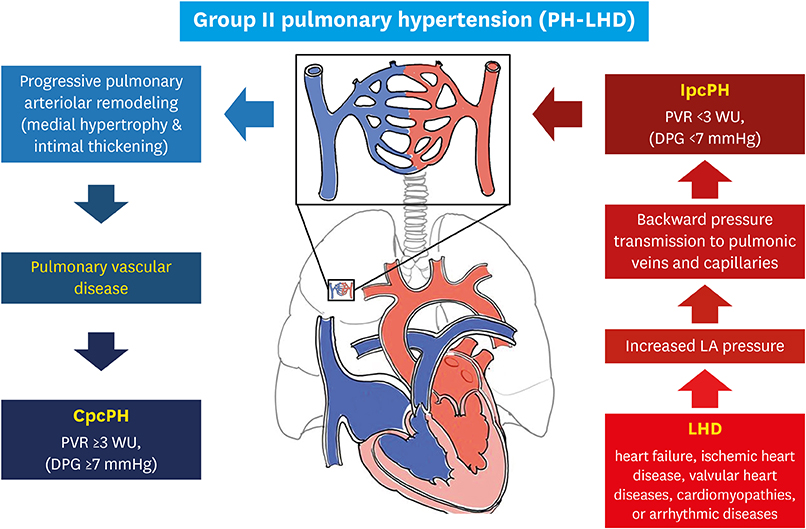
1.2.3. Tăng áp động mạch phổi do các bệnh phổi và/hoặc thiếu Oxy (Pulmonary hypertension due to lung disease or hypoxemia).
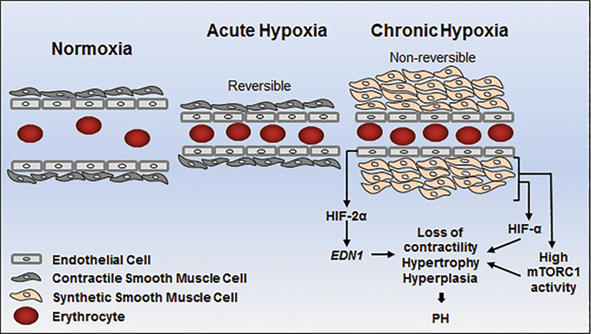
Nhóm này do bệnh phổi tắc nghẽn mạn tính, giảm thông khí phổi, và các nguyên nhân khác gây ra tình trạng thiếu Oxy máu mạn.
1.2.4. Tăng áp động mạch phổi do huyết khối mạn tính (pulmonary hypertension due to pulmonary obstruction)
Nhóm này chủ yếu bao gồm tăng huyết áp phổi do tắc động mạch phổi và cũng bao gồm các nguyên nhân khác của tắc nghẽn động mạch phổi, chẳng hạn như sarcoma, ung thư di căn, và hẹp động mạch phổi bẩm sinh.
1.2.5. Tăng áp động mạch phổi với các cơ chế đa yếu tố không rõ ràng (pulmonary hypertension secondary to unclear or multifactorial mechanisms)
Mức độ nặng của tăng huyết áp phổi được phân loại theo hệ thống phân loại NYHA, được ban đầu phát triển cho suy tim nhưng sau đó được điều chỉnh bởi WHO; nó chủ yếu dựa trên các triệu chứng và trạng thái chức năng:
- Nhóm I: Không giới hạn hoạt động thể chất; không có khó thở, mệt mỏi, đau ngực hoặc gần như không xuất hiện khi vận động.
- Nhóm II: Hạn chế nhẹ hoạt động thể chất; không có triệu chứng ở trạng thái nghỉ ngơi, nhưng khó thở, mệt mỏi, đau ngực hoặc suy nhược xuất hiện khi vận động hoạt động thể chất bình thường.
- Nhóm III: Hạn chế đáng kể hoạt động thể chất; không có triệu chứng ở trạng thái nghỉ ngơi, nhưng khó thở, mệt mỏi, đau ngực hoặc suy nhược xuất hiện khi vận động hoạt động thể chất ít hơn bình thường.
- Nhóm IV: Không thể thực hiện bất kỳ hoạt động thể chất nào mà không có triệu chứng; khó thở và mệt mỏi xuất hiện ngay cả khi nghỉ ngơi và triệu chứng trở nên nặng hơn khi vận động.
2. Cơ chế sinh lý bệnh trong tăng áp động mạch phổi.
2.1. Tổn thương nội mô
Đột biến gen được biết đến bao gồm thụ thể Protein tạo hình thái xương 2 bình thường có tác dụng ức chế tăng sinh cơ trơn mạch máu (Bone morphogenetic protein receptor – BMPR2). 70% tăng áp động mạch phổi có tính chất gia đình và 10 – 40% các trường hợp đơn lẻ hoặc những trường hợp liên quan đến chất gây chán ăn để giảm cân được tìm thấy có đột biến BMPR 2.
VEGF, Endothelin-1 và Survivin là một trong những yếu tố có trong các tổn thương dạng đám rối có thể tăng cường tế bào nội mô và tăng sinh tế bào cơ trơn hoặc giảm quá trình chết theo chương trình của tế bào mạch máu. Những tổn thương này đã làm giảm biểu hiện của các chất trung gian chống tái tạo như Nitric oxide synthase và Prostacyclin synthase, và các chất ức chế khối u, chẳng hạn như Caveolin-1.
Tăng áp động mạch phổi liên quan đến tương tác phức hợp của các yếu tố dẫn đến tái tạo mạch máu tiến triển với tế bào nội mô và sự phát triển cơ trơn, co mạch cũng như huyết khối tiểu động mạch. Rối loạn chức năng nội mô mạch máu phổi dẫn đến tăng nhóm co mạch (ví dụ endothelin) và giảm nhóm giãn mạch (ví dụ NO và prostacyclin). Hậu quả thay đổi tính chất lòng mạch và hẹp lòng mạch, dòng chảy của máu bị hạn chế và tạo ra áp suất cao và kháng lực mạch máu phổi cao (Pulmonary Vascular Resistance – PVR).
Các bằng chứng mới cho thấy các yếu tố virus có thể đóng một vai trò trong các tổn thương tăng sinh tế bào nội mô ở tăng áp động mạch phổi nặng.
Apoptosis tế bào nội mô ban đầu có thể tạo thuận lợi cho sự xuất hiện của các tế bào nội mô kháng apoptosis, có khả năng tăng sinh không kiểm soát được.
2.2. Qúa trình tái tạo các mạch máu trung gian.
Tăng sản tế bào cơ trơn có thể đóng một vai trò nhỏ trong sự dày lên của lớp trung gian so với phì đại tế bào hoặc lắng đọng ở ngoại bào.
Các bằng chứng về sự giảm biểu hiện của BMPR2 được tìm thấy trong vách ngăn phế nang và việc nhận thấy sự giảm của các dạng hoạt hóa của SMAD 1 (Signaling marker for BMPR2) trong các tế bào cơ trơn của các động mạch phổi vẫn chưa rõ làm thế nào đột biến BMPR2 có thể gây ra hoặc kích hoạt bệnh.
Vai trò của serotonin (5-hydroxytryptamine) trong việc kích thích tăng trưởng của các tế bào cơ trơn động mạch phổi đã được nghiên cứu chuyên sâu như một cơ chế tái tạo trung gian trong tăng áp động mạch phổi và một gen điều chỉnh tiềm năng cho tăng áp động mạch phổi tính chất gia đình.
Mặc dù có bằng chứng ủng hộ việc mất chức năng TGF-β, đặc biệt là trong các tế bào nội mô của tăng áp động mạch phổi tính chất gia đình, TGF-β có thể tạo ra những thay đổi về chức năng làm cơ sở cho sự phát triển của tế bào cơ trơn và kích hoạt nguyên bào sợi ngoại lai.
Các nghiên cứu gần đây về hoạt động của kênh K + đã cung cấp một cái nhìn sâu sắc mới về việc thiếu tín hiệu Proapoptotic trong các tế bào cơ trơn.
Một nghiên cứu thú vị dựa trên sự tương tác giữa các kênh K+ và quá trình chết theo chương trình trong các tế bào cơ trơn động mạch phổi đã chứng minh việc kích hoạt các kênh K+ gây ra sự giải phóng cytochrom C từ ty thể. Ngược lại, ức chế kênh K+ gây khử cực tế bào, tăng khả năng co bóp và giảm quá trình chết theo chương trình của tế bào cơ trơn động mạch phổi.
Một cơ chế tiềm năng thể hiện sự liên kết với đột biến BMPR2 đã phát hiện ra rằng kích hoạt BMPR2 điều chỉnh tăng kênh K+ và gây ra quá trình chết theo chương trình của các tế bào cơ trơn động mạch phổi bình thường, chứ không phải tế bào của bệnh nhân mắc tăng áp động mạch phổi tính chất gia đình.
Survivin thiếu hụt một cách ngẫu nhiên trong quá trình tái tạo mạch máu động mạch phổi được điều trị bằng Monocrotaline và khi được dùng sau khi điều trị bằng Monocrotaline, nó sẽ tiêu diệt quá trình chết theo chương trình của các tế bào cơ trơn động mạch phổi và làm giảm áp lực động mạch phổi.
2.3. Qúa trình tái tạo ngẫu nhiên
Các nguyên bào sợi trải qua một sự gia tăng rõ rệt về sự tăng sinh tế bào đạt mức tăng gấp 11 lần ở các mạch máu rốn phổi, vào ngày thứ 3 của tình trạng thiếu oxy mãn tính.
Các nguyên bào sợi có thể
- Biệt hóa thành các tế bào cơ trơn và di chuyển vào môi trường đã được tu sửa hoặc;
- Kích hoạt sự tăng sinh tế bào cơ trơn bằng cách tiết ra các yếu tố tăng trưởng;
- Cho phép sử dụng các tế bào tiền thân viêm và tủy xương;
- Tạo ra một ngách ‘tạo mạch và tạo mạch’ để tăng các mạch mới hình thành (vasa vasorum).
Các nguyên bào sợi cảm nhận được sự thay đổi trong trạng thái oxy hóa khử, dẫn tới kích hoạt của sự tăng sinh tế bào, giải phóng cytokine và tạo ra các chất oxy hóa thông qua kích hoạt NADPH oxyase.
2.4. Tác động của tĩnh mạch.
Người ta biết rất ít về sự thay đổi chức năng của nội mô, cơ trơn và nguyên bào sợi trong tăng áp tĩnh mạch phổi. Các tĩnh mạch phổi rất khó xác định trong các phần phổi, do thực tế là chúng nằm ở giữa các mô có phế nang. Chỉ các đoạn tĩnh mạch hiện diện trong vách ngăn gian tiểu thuỳ mới có thể dễ dàng nhận ra hơn. Sự phát triển của các tế bào nội mô đối với các tĩnh mạch phổi sẽ giúp đánh giá đúng sự tác động của rối loạn chức năng tế bào nội mô trong tăng huyết áp phổi tĩnh mạch.
2.5. Viêm, sự lưu thông các tế bào tiền thân và các tác nhân virus.
Mặc dù viêm quanh mạch máu có giá trị hạn chế trong quá trình giải quyết bệnh lý của các trường hợp tăng áp động mạch phổi , nhưng hiện tại đây là một trong những lĩnh vực hứa hẹn nhất về bệnh. Các tế bào viêm có thể tương tác với các yếu tố virus, đã nổi lên như là tác nhân gây bệnh/căn nguyên tiềm ẩn trong tăng áp động mạch phổi.
Các nghiên cứu chứng minh rằng sự cạn kiệt của các tế bào monocytic trong tuần hoàn làm giảm bớt sự tái tạo mạch máu phổi do tình trạng thiếu oxy mãn tính.
Nhiễm virus có thể làm gián đoạn quá trình điều hòa miễn dịch và cân bằng nội môi bình thường của tế bào, dẫn đến tổn thương tế bào nội mô hoặc tế bào cơ trơn và kích hoạt phản ứng viêm. Vai trò quan trọng của tình trạng viêm được nhấn mạnh hơn nữa trong các trường hợp PH có thể xác định được nguyên nhân do virus.
Đột biến BMPR2 không bắt buộc đối với tăng áp động mạch phổi nghiêm trọng xảy ra ở bệnh nhân nhiễm HIV, tuy nhiên các tổn thương mạch máu ở phổi từ bệnh nhân nhiễm HIV giống hệt với những người mắc tăng áp động mạch phổi tính chất gia đình với đột biến BMPR2.
Nguồn tham khảo:
Refenrence
Maxine A. Papadakis, Stephen J.McPhee, Michael W.Rabow: CURRENT Medical Diagnosis & Treatment, 2023, p301.
Hemant Godara, Angela Hirbe, Michael Nassif, Hannah Otepka, Aron Rosenstock: The Washington Manual of Medical Therapeutics 34th Edition, 2014, p405.
Humbert M, Kovacs G, Hoeper MM, et al.,: Guidelines for the Diagnosis and Treatment of Pulmonary Hypertension: Developed by the Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), 2022.
Rubin M. Tuder, M.D.,a,b John C. Marecki, Ph.D.,c Amy Richter, B.S.,d Iwona Fijalkowska, Ph.D.,d,e and Sonia Flores, Ph.D: Pathology of Pulmonary Hypertension, 2007.
Tao Le, Matthew Sochat, Connie Qiu, Panagiotis Kaparaliotis, Kimberly Kallianos, Vikas Bhushan, Caroline Coleman, Anup Chalise, Stephanie Jones: FIST AID FOR THE USMLE STEP 1, 2022, p704.
Leave a Reply